Что за полезное ископаемое радиоактивный металл

Главная » Металлы » Виды и характеристики радиоактивных металлов
На чтение 5 мин.
Радиоактивные металлы занимают значительную часть периодической таблицы Менделеева. Одни о них говорят со страхом, другие с интересом. Данные элементы обладают уникальными свойствами, за которые ценятся научным сообществом, но вредны для человека. Излучение, которое исходит от этих металлов, провоцирует разрушение внутренних органов.
Химические элементы
Какие элементы относятся к радиоактивным?
Группа радиоактивных элементов в периодической таблице Менделеева начинается от свинца и заканчивается последней ячейкой. Излучение происходит из-за определенного периода полураспада — преобразования металлического ядра в дочернее. Радиоактивные элементы:
- уран;
- плутоний;
- радий;
- берклий;
- торий;
- нептуний;
- франций;
- эйнштейний;
- технeций.
Среди них присутствуют цветные и черные радиоактивные металлы.
Существуют три вида радиоактивного излучения — альфа, бета, гамма. Они отличаются длиной волны, проникающей способностью. Если альфа излучение может сдержать плотная бумага или картон, то гамма излучение остановит только слой свинца.
Химический элемент нептуний (Фото: Instagram / amurasoap)
История открытия
Открытием радиации человечество обязано прусскому физику Вильгельму Рентгену. В 1895 году он смог увидеть радиоактивное излучение. Благодаря работам этого ученого был разработан рентгеновский аппарат.
Изучение радиоактивности продолжил Анри Беккерель в 1896 году. Этот ученый проводил эксперименты с солями урана. Прорыв в данной области произошел через 2 года. Пьер Кюри получил первый чистый радиоактивный материал — радий. После открытия этого элемента ученый не смог продолжить его изучение, поскольку умер от излучения.
Следующее продвижение в этой области произошло в 1934 году. В этот год ученые смогли синтезировать искусственный радиоактивный изотоп. Сейчас эта область является одной из самых актуальных. Ее изучением занято огромное количество ученых, крупных научных организаций.
Запасы и месторождения
Запасы и месторождения представителей радиоактивной группы:
- Уран. Залежи металла в слоях литосферы на толщину 20 км — 1.3х1014 т. Содержание в морской воде — 3 мкг/л. Больше всего урана содержится в кислых породах, содержащих кремний.
- Радий. Редкий элемент. За все время было добыто не более 1,5 килограмма чистого радия. Природный радий появляется после распада урана 235 и урана 238.
- Плутоний. Из-за отсутствия стабильных изотопов его сложно найти в природе. Изотопы, с длительным периодом полураспада — 239, 244. В природе он встречается в виде соединения PuO2. Его добыча не имеет смысла из-за малого количества.
- Торий. Был открыт в 1815 году. Все природные изотопы элемента состоят из этого нуклида. В большом количестве содержится в природе. Самые стабильные изотопы — 232, 230, 229.
- Берклий. Некоторые изотопы этого радиоактивного элемента можно получить при облучении урановых, плутониевых руд в ядерных реакторах. Самые стабильные изотопы — 247, 249.
Большинство радиоактивных металлов редко встречаются в природе, добывать их сложно.
Добыча руды (Фото: Instagram / nornickel_official)
Добыча и промышленное получение
В чистом виде естественные радиоактивные металлы найти невозможно. Чаще их синтезируют из урановых руд. Это затратный, трудоемкий процесс, состоящий из нескольких этапов:
- Концентрирование. Руду дробят в воде для выделения осадка.
- Выщелачивание. Осадок переводится в раствор.
- Выделение чистого урана.
- Перевод в твердое состояние.
После обработки из тонны руды получается несколько грамм чистого вещества. Проводить подобные процедуры можно только в специальных цехах.
Свойства и характеристики
Знание характеристик радиоактивных металлов поможет выявить уникальные свойства этих элементов, понять, где их лучше применять.
Уран
Свойства:
- В свободном состоянии — светло-серый металл.
- Плотность — 18700 кг/м3.
- Атомный номер — 92.
- Электросопротивление — 29,0•10-4 (Ом•м).
- Температура плавления — 1135°C.
- Теплоемкость — 27,66 Дж/(моль•К).
- Температура кипения — 3818°C.
- Теплопроводность — 22,5 Вт/(м•К).
- Степень окисления — до +6.
- Коэффициент линейного расширения — 10,7•10-6 К-1.
Уран растворяется в азотной и соляной кислоте, не взаимодействует с щелочами. При нагревании может вступать в реакции с азотом, фосфором.
Химический элемент уран
Радий
Характеристики:
- В нормальном состоянии — серебристо-белый металл.
- Показатель плотности — 5500 кг/м3.
- Атомный номер — 88.
- Показатель теплоемкости — Cp0 29 Дж/(моль•К).
- Температура плавления — 969°C.
- Степень окисления — +2.
- Температура кипения — 1500°C.
По химической активности радий можно сравнить с барием. На воздухе быстро окисляется. При соединении с водой возникает бурная реакция с нагреванием жидкости.
Плутоний
Характеристики:
- При нормальном состоянии — серебристо-белый металл.
- Показатель плотности — 19,82 (25°C, г/см3).
- Атомный норме — 94.
- Удельное электрическое сопротивление — 150 мкОм·см (при +22 °C).
- Температура плавления — 640°C.
- Температура кипения — 3235°C.
Вступает в реакцию с водой.
Окисленный плутоний (Фото: Instagram / thoisoi)
Сферы применения
Радиоактивные металлы применяются в разных направлениях. С их помощью проводят эксперименты, изучают влияние на другие материалы, живые организмы. Часто используются для выработки энергии в реакторах.
Влияние на организм
Радиоактивное излучение разрушает внутренние органы. Естественные механизмы защиты организма справляются только с малыми дозами излучения. Когда они становятся большими, развивается лучевая болезнь, повышается риск поражения организма раком.
Радиоактивные металлы обладают уникальными свойствами. Их изучением ученые занимаются постоянно. Исследователи находят новые способы получения металлов, сферы для их применения.
Источник
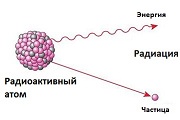
Радиоактивные металлы — это металлы, которые самопроизвольно излучают поток элементарных частиц во внешнюю среду. Этот процесс называют альфа(α), бета(β), гамма(γ) излучением или просто радиоактивным излучением.
Все радиоактивные металлы со временем распадаются и превращаются в стабильные элементы (иногда проходя целую цепочку превращений). У разных элементов радиоактивный распад может длиться от нескольких миллисекунд до нескольких тысяч лет.
Рядом с названием радиоактивного элемента часто указывается массовое число его изотопа. Например, Технеций-91 или 91Tc. Разные изотопы одного и того же элемента как правило имеют общие физические свойства и различаются лишь длительностью радиоактивного распада.

Список радиоактивных металлов
| Название рус. | Название eng. | Самый стабильный изотоп | Период распада |
|---|---|---|---|
| Технеций | Technetium | Tc-91 | 4.21 x 106 лет |
| Прометий | Promethium | Pm-145 | 17.4 года |
| Полоний | Polonium | Po-209 | 102 года |
| Астат | Astatine | At-210 | 8.1 часов |
| Франций | Francium | Fr-223 | 22 минут |
| Радий | Radium | Ra-226 | 1600 лет |
| Актиний | Actinium | Ac-227 | 21.77 лет |
| Торий | Thorium | Th-229 | 7.54 x 104 лет |
| Протактиний | Protactinium | Pa-231 | 3.28 x 104 лет |
| Уран | Uranium | U-236 | 2.34 x 107 лет |
| Нептуний | Neptunium | Np-237 | 2.14 x 106 лет |
| Плутоний | Plutonium | Pu-244 | 8.00 x 107 лет |
| Америций | Americium | Am-243 | 7370 лет |
| Кюрий | Curium | Cm-247 | 1.56 x 107 лет |
| Беркелий | Berkelium | Bk-247 | 1380 лет |
| Калифорний | Californium | Cf-251 | 898 лет |
| Эйнштейний | Einsteinium | Es-252 | 471.7 дней |
| Фермий | Fermium | Fm-257 | 100.5 дней |
| Менделевий | Mendelevium | Md-258 | 51.5 дней |
| Нобелий | Nobelium | No-259 | 58 минут |
| Лоуренсий | Lawrencium | Lr-262 | 4 часа |
| Резенфордий | Rutherfordium | Rf-265 | 13 часов |
| Дубний | Dubnium | Db-268 | 32 часа |
| Сиборгий | Seaborgium | Sg-271 | 2.4 минуты |
| Борий | Bohrium | Bh-267 | 17 секунд |
| Ганий | Hassium | Hs-269 | 9.7 секунд |
| Мейтнерий | Meitnerium | Mt-276 | 0.72 секунды |
| Дармштадий | Darmstadtium | Ds-281 | 11.1 секунды |
| Рентгений | Roentgenium | Rg-281 | 26 секунд |
| Коперниций | Copernicium | Cn-285 | 29 секунд |
| Унунтрий | Ununtrium | Uut-284 | 0.48 секунд |
| Флеровий | Flerovium | Fl-289 | 2.65 секунд |
| Унунпентий | Ununpentium | Uup-289 | 87 миллисекунд |
| Ливерморий | Livermorium | Lv-293 | 61 миллисекунда |
Радиоактивные элементы делятся на естественные (существующие в природе) и искусственные (получаемые в результате лабораторного синтеза). Естественных радиоактивных металлов не много — это полоний, радий, актиний, торий, протактиний и уран. Их наиболее стабильные изотопы встречаются в природе, чаще в виде руды. Все остальные металлы из списка созданы человеком.
Самый радиоактивный металл
Самый радиоактивный металл на данный момент — ливерморий. Его изотоп Ливерморий-293 распадается всего за 61 милисекунду. Впервые этот изотоп был получен в Дубне, в 2000 году.
Другой очень радиоактивный металл — унунпентий. Изотоп унунпентий-289 имеет чуть больший период распада (87 милисекунд).
Из более-менее стабильных, практически применяемых веществ, самым радиоактивным металлом считается полоний (изотоп полоний-210). Это серебристый белый радиоактивный металл. Хотя его период полураспада достигает 100 и более дней, даже один грамм этого вещества раскаляется до 500°C, а излучение может мгновенно убить человека.
Что такое радиация
Всем известно, что радиация очень опасна и лучше держаться подальше от радиоактивного излучения. С этим трудно поспорить, хотя в реальности мы постоянно подвержены влиянию радиации, где бы не находились. В земле залегает довольно большое количество радиоактивной руды, а из космоса на Землю постоянно прилетают заряженные частицы.
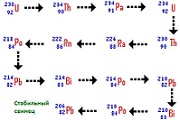
Кратко говоря, радиация это самопроизвольное испускание элементарных частиц. От атомов радиоактивного вещества отделяются протоны и нейтроны, «улетая» во внешнюю среду. Ядро атома при этом постепенно изменяется, превращаясь в другой химический элемент. Когда все нестабильные частицы отделяются от ядра, атом перестает быть радиоактивным. Например, торий-232 в конце своего радиоактивного распада превращается в стабильный свинец.
Наука выделяет 3 основных вида радиоактивного излучения
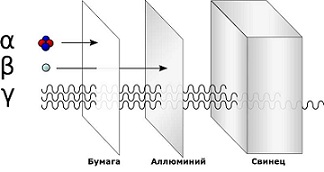
Альфа излучение(α) — поток альфа-частиц, положительно заряженных. Они сравнительно большие по размеру и плохо проходят даже через одежду или бумагу.
Бета излучение(β) — поток бета-частиц, негативно заряженных. Они довольно малы, легко проходят через одежду и проникают внутрь клеток кожи, что наносит большой вред здоровью. Но бета-частицы не проходят через плотные материалы, такие как алюминий.
Гамма излучение(γ) — это высокочастотная электромагнитная радиация. Гамма-лучи не имеют заряда, но содержат очень много энергии. Скопление гамма-частиц излучает яркое свечение. Гамма-частицы проходят даже через плотные материалы, что делает их очень опасными для живых существ. Их останавливают только самые плотные материалы, например, свинец.
Все эти виды излучения так или иначе присутствуют в любой точке планеты. Они не представляют опасности в малых дозах, но при высокой концентрации могут причинить очень серьезный ущерб.
Изучение радиоактивных элементов



Первооткрывателем радиоактивности является Вильгельм Рентген. В 1895 году этот Прусский физик впервые наблюдал радиоактивное излучение. На основе этого открытия был создан знаменитый медицинский прибор, названый в честь ученого.
В 1896 г изучение радиоактивности продолжил Анри Беккерель, он экспериментировал с солями урана.
В 1898 г Пьер Кюри в чистом виде получил первый радиоактивный металл — Радий. Кюри хоть и открыл первый радиоактивный элемент, однако, не успел толком его изучить. И выдающиеся свойства радия привели к быстрой гибели ученого, который беспечно носил свое «детище» в нагрудном кармане. Великое открытие отомстило своему первооткрывателю — Кюри умер в возрасте 47 лет от мощной дозы радиоактивного облучения.
В 1934 г был впервые синтезирован искусственный радиоактивный изотоп.
Сейчас изучением радиоактивности занимаются множество ученых и организаций.
Добыча и синтез



Даже естественные радиоактивные металлы не встречаются в природе в чистом виде. Их синтезируют из урановой руды. Процесс получения чистого металла чрезвычайно трудоемок. Состоит он из нескольких стадий:
- концентрирование (дробление и выделение осадка с ураном в воде);
- выщелачивание — то есть, перевод уранового осадка в раствор;
- выделение чистого урана из полученного раствора;
- перевод урана в твердое состояние.
В итоге, из тонны урановой руды можно получить всего несколько граммов урана.
Синтез искусственных радиоактивных элементов и их изотопов проходит в специальных лабораториях, в которых создаются условия для работы с подобными веществами.
Практическое применение
Чаще всего, радиоактивные металлы используют для выработки энергии.
Ядерные реакторы — это устройства, использующие уран для нагревания воды и создания потока пара, который вращает турбину, с помощью чего вырабатывается электричество.


Вообще, сфера применения радиоактивных элементов довольно широка. Они используются для изучения живых организмов, диагностирования и лечения болезней, выработки энергии и для мониторинга промышленных процессов. Радиоактивные металлы являются основой для создания ядерного оружия — самого разрушительного оружия на планете.
Источник
Пост обновлен май 1
Рудные полезные ископаемые залегают на фундаментах и выступах (щитах) древних платформ, а также в складчатых областях.
Исходя из области применения, рудные полезные ископаемые делятся на 4 группы
Руды черных металлов
Руды цветных металлов
Руды благородных металлов
Радиоактивные металлы
Первые две группы встречаются чаще всего
Руды черных металлов (Железная руда)
Среди руд черных металлов наиболее востребованными и используемыми в промышленности являются железные руды.
Железная руда является основой для производства черных металлов – чугуна, стали, проката.
Крупнейшие запасы железных руд сосредоточены в США, Индии, Китае, Бразилии, Канаде.
Есть отдельные крупные месторождения в Казахстане, Франции, Швеции, Украине, Венесуэле, Перу, Чили, Австралии, Либерии, Малайзии, В странах Северной Африки.
В России крупные запасы железных руд, кроме КМА, есть на Урале, Кольском полуострове, в Карелии.
Руды цветных металлов
Цветные металлы делятся на две группы:
легкие — алюминий, магний, титан
тяжелые – медь, цинк, свинец, никель, кобальт.
Алюминиевая промышленность
Алюминий — самый распространенный цветной металл в земной коре.
Производство алюминия можно разделить на три части:
Добыча сырья для алюминиевой промышленности — бокситов
Бокситы перерабатываются на глинозем
Из расплава глинозема получают алюминий
Первичный алюминий — алюминий, который производят из сырья — бокситов
Вторичный алюминий — переплавленный алюминий (Промышленность развитых стран нацелена на производства вторичного алюминия)
Рейтинг стран по добыче бокситов:
Гвинея
Австралия
Бразилия
Ямайка
Камерун
Индия
Преимущественно бокситы распространены во влажных тропиках и субтропиках.
Карта, показывает какие страны лидирует по добыче бокситов
Факторы размещения алюминиевой промышленности
1) Сырьевой
Предприятия располагают вблизи источников сырья — бокситов или глинозема.
При производстве вторичного алюминия предприятия расположены вблизи крупных потребителей аллюминия.
2) Энергетический
Для производства алюминия необходимо много энергии, поэтому предприятия располагают вблизи источников дешевой электроэнергии (например в Бразилии это гидроэнергетика, в странах персидского залива дешевая энергия вырабатывается на ТЭС).
3) Водный
Для производства алюминия необходимо большое количество воды, поэтому предприятия чаще всего располагают вблизи крупных рек.
Пример:
Какие факторы способствовали размещению крупного завода по производству первичного алюминия Красноярске.
1) В Красноярском крае протекает крупная река — Енисей, а производство аллюминия водоемкое производство
2) Красноярский край обеспечен дешевой электроэнергией, за счет мощных ГЭС.
Медная промышленность
Медь — один из самых распространенных и наиболее ценных цветных металлов
Электротехническая промышленность является крупнейшим потребителем меди
Чаще всего медную руду добывают вместе с никелевой рудой
Изготовление чистой меди (рафинированной) требует больших затрат электроэнергии
Больше всего меди добывают: Чили, Перу, Россия, Австралия и Канада
Рейтинг стран по выплавке меди:
Чили
Китай
Перу
США
Австралия
Россия
Карта, показывает какие страны лидирует по выплавке меди
США является не только крупным изготовителем рафинированной меди, но даже импортирует медь.
Причина: развитое производство электротехнических изделий
Оловянные Руды
Оловянная промышленность сосредоточена в Юго-Восточной Азии, в основном в Малайзии
Оловянную руду изготавливают в местах его добычи, т. к. для выплавки тонны олова надо переработать 900 тонн руды.
Рединг стран по добыче олова
Австралия
Боливия
Бразилия
Мьянма
Китай
Д.Р.Конго
Индонезия
Малайзия
Воздействие на окружающую среду
Рост производства и потребления цветных металлов был причиной возникновения крупных экологических проблем.
Добыча руд тяжелых цветных металлов характеризуется очень низким содержанием металла поэтому образуются терриконы — отходы горной породы. Терриконы загрязняют почву и воздух.
Производство металла сопровождается большим количеством выбросов серы в атмосферу
Руды благородных металлов
Золото
Золото практически не подвержено коррозии и высоко ценится, оно сохраняется вечно, поэтому считается дорогим металлом
Страны — лидеры по запасам золота:
ЮАР
США
Россия
Серебро
Страны — лидеры по запасам серебра:
Мексика
Перу
США
Канада
Знания по географии размещения основных полезных ископаемых понадобятся в 19 задание ЕГЭ, понимание факторов размещения понадобится для решения 29 и 30 заданий ЕГЭ.
Источник
по
применению Классификации запасов
месторождений
и прогнозных ресурсов
твердых
полезных ископаемых
Радиоактивные
металлы
Москва,
2007
Разработаны
Федеральным государственным учреждением
«Государственная комиссия по запасам
полезных ископаемых» (ФГУ ГКЗ) по заказу
Министерства природных ресурсов
Российской Федерации и за счет средств
федерального бюджета.
Утверждены
распоряжением МПР России от 05.06.2007 г. №
37-р.
Методические
рекомендации
по применению Классификации запасов
месторождений и прогнозных ресурсов
твердых полезных ископаемых.
Радиоактивные металлы.
Предназначены
для работников предприятий и организаций,
осуществляющих свою деятельность в
сфере недропользования, независимо
от их ведомственной принадлежности и
форм собственности. Применение
настоящих Методических рекомендаций
обеспечит получение геологоразведочной
информации, полнота и качество которой
достаточны для принятия решений о
проведении дальнейших разведочных
работ или о вовлечении запасов разведанных
месторождений в промышленное освоение,
а также о проектировании новых или
реконструкции существующих предприятий
по добыче и переработке полезных
ископаемых.
Ископаемых (радиоактивных металлов)
I. Общие сведения
1.
Настоящие Методические
рекомендации по применению Классификации
запасов месторождений и прогнозных
ресурсов твердых полезных ископаемых
(радиоактивных
металлов)
(далее
– Методические рекомендации) разработаны
в соответствии с Положением
о Министерстве природных ресурсов
Российской Федерации, утвержденным
постановлением Правительства Российской
Федерации от 22 июля 2004 г. № 370 (Собрание
законодательства Российской Федерации,
2004, № 31, ст.3260; 2004, № 32, ст. 3347, 2005, № 52
(3ч.),
ст. 5759; 2006, №
52 (3ч.),
ст. 5597),
Положением о Федеральном агентстве по
недропользованию, утвержденным
постановлением Правительства Российской
Федерации от 17 июня 2004 г. № 293 (Собрание
законодательства Российской Федерации,
2004, N 26, ст. 2669; 2006, №25, ст.2723),
Классификацией запасов месторождений
и прогнозных ресурсов твердых полезных
ископаемых, утвержденной приказом МПР
России от 11 декабря 2006 г. № 278, и содержат
рекомендации по применению Классификации
запасов месторождений и прогнозных
ресурсов твердых полезных ископаемых
в отношении
радиоактивных металлов
.
2.
Методические
рекомендации направлены на оказание
практической помощи недропользователям
и организациям, осуществляющим подготовку
материалов по подсчету запасов полезных
ископаемых и представляющих их на
государственную экспертизу.
3.
У р а н.
Металл
светло-серого цвета, легко поддается
обработке, сравнительно мягкий, на
воздухе темнеет, покрываясь пленкой
оксида. Кларк урана – 2,5∙10–4 %, т.е. выше
кларков многих редких металлов (Mo, W,
Hg). Атомный номер Z=92, атомная масса
А=238,029. Существует в трех кристаллических
модификациях. Плотность 18,7–19,5∙103
кг/м3,
твердость по Бринеллю 19,6–21,6∙102
Мн/м2
(200–220
кГс/мм2),
слабый парамагнетик (удельная магнитная
восприимчивость 1,72∙10–6).
Температура плавления 1135 С°.
Радиоактивен, в порошке пирофорен, в
растворах токсичен.
Уран
химически весьма активный элемент. Он
быстро окисляется на воздухе, разлагает
воду при 102 С°,
легко реагирует со всеми неметаллами,
образует ряд интерметаллических
соединений. Уран
относится к III группе периодической
системы Менделеева, открывая, наряду с
торием, семейство актиноидов, представленное
в основном трансурановыми, искусственно
получаемыми элементами (плутоний,
америций, кюрий и др.). Однако по химическим
свойствам уран имеет много общих черт
с элементами IV группы (Mo, W, Cr). Он
поливалентен, в четырехвалентном
состоянии амфотерен и склонен к
изоморфизму с Са, Ti, Th и редкими землями.
В шестивалентном состоянии в нейтральных
и кислых растворах образует комплексный
уранил-ион (UO2)+2.
Большинство
соединений четырехвалентного урана
нерастворимо в воде. В то же время
большинство солей уранила – сульфаты,
нитраты, карбонаты – хорошо растворимы.
Различная растворимость урана в четырех
и шестивалентном состоянии определяет
условия его миграции и является главным
фактором образования его концентраций
в природе.
Фторид
шестивалентного урана (гексафторид)
возгоняется при 56 С°
и используется в процессе обогащения
природного урана изотопом 235U.
Природный
уран состоит из смеси трех изотопов:
238U
(99,2739 %), 235U
(0,7024 %) и 234U
(0,0057 %). Периоды полураспада этих изотопов
соответственно равны: 4,51∙109
лет, 7,13∙108
лет и 2,48∙105
лет.
Изотопы
урана 238U
и 235U
в результате радиоактивного распада
образуют два радиоактивных ряда:
уран-радиевый и актино-урановый. Конечными
продуктами распада рядов являются
устойчивые изотопы 206Рb,
207Рb
и гелий. Из промежуточных продуктов
практическое значение имеют радий 226Ra
и радон 222Rn.
С
течением времени, через
интервал равный примерно десяти периодам
полураспада наиболее долгоживущего
дочернего продукта,
в радиоактивном ряду урана наступает
состояние устойчивого радиоактивного
равновесия, при котором число распадающихся
в единицу времени атомов всех элементов
ряда одинаково.
Р
а д и й
(226Ra)
щелочноземельный металл, гомолог бария,
является в ряду распада 238U
основным гамма-излучателем. Чистый уран
испускает только слабопроникающие
альфа-лучи. Период полураспада радия
1590 лет. Радиоактивное
равновесие между ураном и радием
наступает через 8∙105
лет и наблюдается в древних, хорошо
сохранившихся породах и минералах. При
радиоактивном равновесии одному грамму
урана соответствует 3,4∙10–7
грамма радия.
В равновесном ряду интенсивность
гамма-излучения пропорциональна
содержанию урана, что позволяет
осуществлять экспресс-анализ урановых
руд, а также их сортировку и радиометрическое
обогащение. Однако в незамкнутых
природных системах равновесие между
ураном и радием может нарушаться,
поскольку эти элементы имеют различную
миграционную способность.
Состояние
равновесия системы принято выражать
коэффициентом радиоактивного равновесия:
Крр=
2,94∙108
СRa/
СU,
где
СRa
и CU
– содержания радия и урана в %%.
Необходимость
изучения состояния радиоактивного
равновесия составляет одну из особенностей
разведки и оценки урановых месторождений.
Р
а д о н(222Rn)
представляет собой инертный газ, хорошо
растворимый в воде. Период полураспада
радона очень мал – 3,8 суток. Поэтому его
высокая миграционная способность обычно
не приводит к изменению соотношения
между гамма-активными продуктами и
ураном. Однако при бурении разведочных
скважин в обводненных ураноносных
породах может происходить отжатие
буровым раствором пластовых вод с
растворенным радоном из околоскважинного
пространства, за счет чего интенсивность
измеряемого каротажом гамма-излучения
окажется ниже соответствующей содержанию
урана. Необходимость изучения и учета
этого явления составляет еще одну
особенность разведки и оценки некоторых
типов урановых месторождений.
Урановые
руды выделяют радон в окружающую среду
(эманируют). Именно радон, попадая из
рудничной атмосферы в легкие человека
и распадаясь там на твердые более
долгоживущие продукты, является одним
из главных факторов радиационной
опасности на урандобывающих предприятиях.
Способность
руд к эманированию требует специального
изучения (оценки удельного радоновыделения
–УЭР), а проходка подземных горных
выработок на урановых месторождениях,
– специальных мер безопасности (усиленная
вентиляция, бетонирование обнаженных
поверхностей и др.).
Минералогия
урана исключительно разнообразна.
Известно около 300 урановых и урансодержащих
минералов, однако основную массу
промышленных руд обычно слагают следующие
(табл.1).
Таблица
1
Важнейшие
урановые минералы
Минералы | Химический | Содержание тория |
Уранинит | (U,Th)O2х | 62–85 |
Настуран | U02х | 52–76 |
Урановые | U02х | 11–53 |
Браннерит | (U, | 35–50 |
Коффинит | U | 60–70 |
Давидит | (Fe,Ce,U)(Ti,Fe,V,Cr)3(O,OH)7 | 1–7 |
Нингиоит | CaU(P04)2∙2H2O | 20–30 |
Карнотит | K2(UO2)2(VO4)2∙3H2 | 52–66 |
Торбернит | Cu | 48 |
Отенит | Ca(UO2)2(P04)2∙10H2 | 48–54 |
Уранофан | Ca[UO2(SiO3OH)] | 55–58 |
Цейнерит | Cu | 55 |
Тюямунит | Ca | 57–65 |
Казалит | Pb[UO2SiO4]∙H2 | 42–50 |
В
некоторых типах месторождений основным
носителем урана является ураноносный
фторапатит, в котором уран изоморфно
замещает Са.
4.
Т о р и й.Пластичный
металл серебристо-белого цвета, на
воздухе медленно окисляется. Атомный
номер 90, атомная масса 232,038. Существует
в двух кристаллических модификациях.
Плотность 11,72∙103
кг/м3,
твердость по Бринеллю 450–700 Мн/м2
(45–70
кгс/мм2),
парамагнитен (удельная магнитная
восприимчивость 0,54∙10–6).
Температура плавления 1750 Со.
Разлагает воду при 200 Со,
на холоде медленно реагирует с азотной,
серной, плавиковой кислотами, легко
растворяется в соляной кислоте и царской
водке. Радиоактивен.
Природный
торий практически состоит из одного
долгоживущего изотопа 232Th
с периодом полураспада 1,39∙1010
лет
(содержание 238Th,
находящегося с ним в равновесии, ничтожно
– 1,37∙10–8
%). Конечный продукт ряда распада
стабильный 208Pb.
Продукты, способные обусловить нарушение
равновесия в ряду отсутствуют. Один из
промежуточных продуктов – инертный
газ торон (Tn)
крайне короткоживущий (полураспад 54
сек). Радиоактивное равновесие между
торием и основным его гамма-излучателем
мезоторием (MsTh2)
наступает через 75 лет.
В
природных соединениях Th исключительно
четырехвалентен. Большинство его
соединений нерастворимо. В поверхностных
условиях мигрирует только путем
механического переноса минералов.
Накапливается в россыпях.
Несмотря
на относительно высокий кларк (8 ∙10–4
%), торий склонен к рассеянию. Собственные
его минералы редки. В качестве изоморфной
примеси встречается в различных минералах
редких земель и тантала-ниобия. Наиболее
практически важные минералы приведены
в таблице 2.
В
заметных количествах в настоящее время
торий не добывается. Применение его в
технике незначительно (в виде тугоплавкого
оксида и для легирования некоторых
специальных сплавов).
Таблица
2
Соседние файлы в папке Мет.рек.ГКЗ 2007
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник

