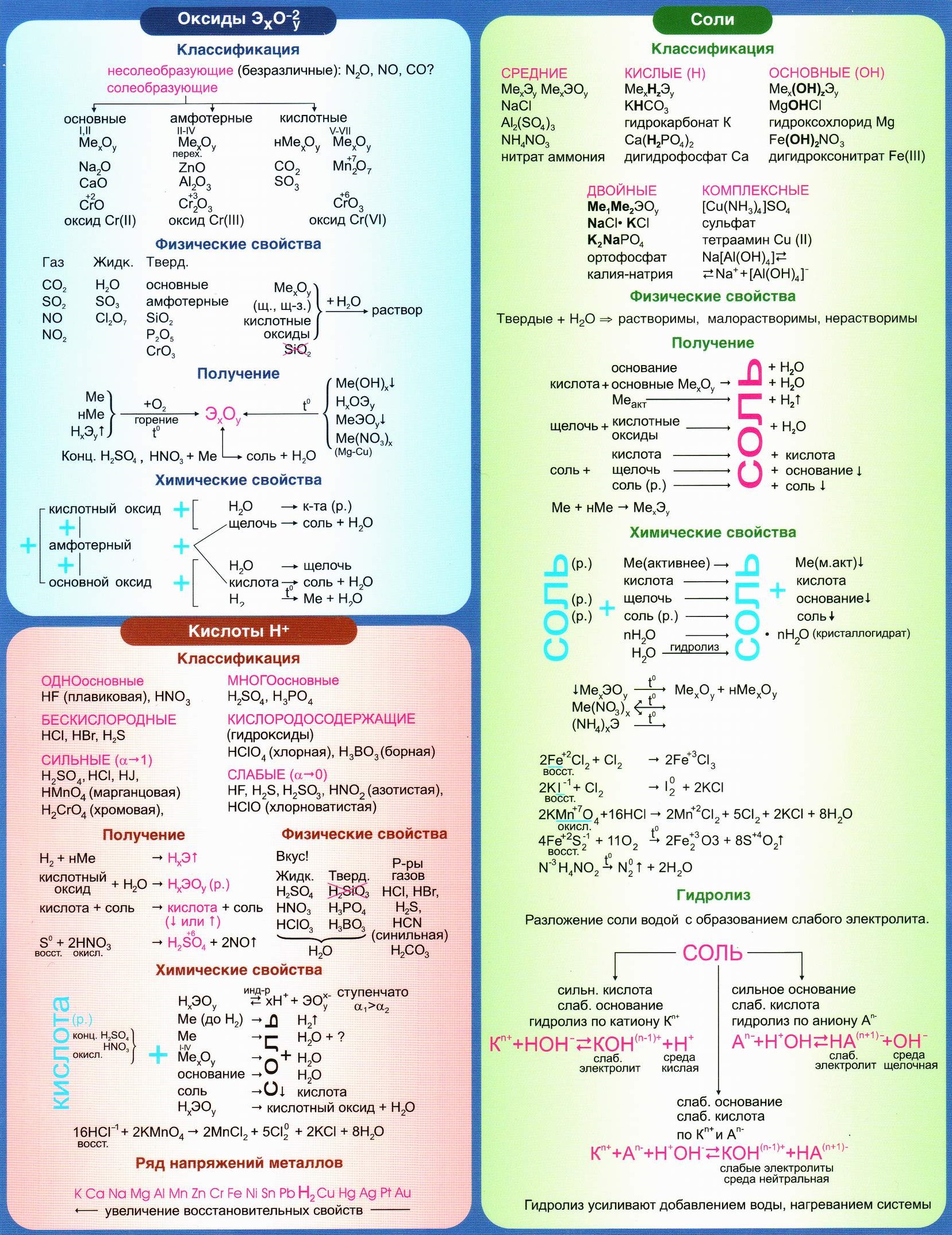
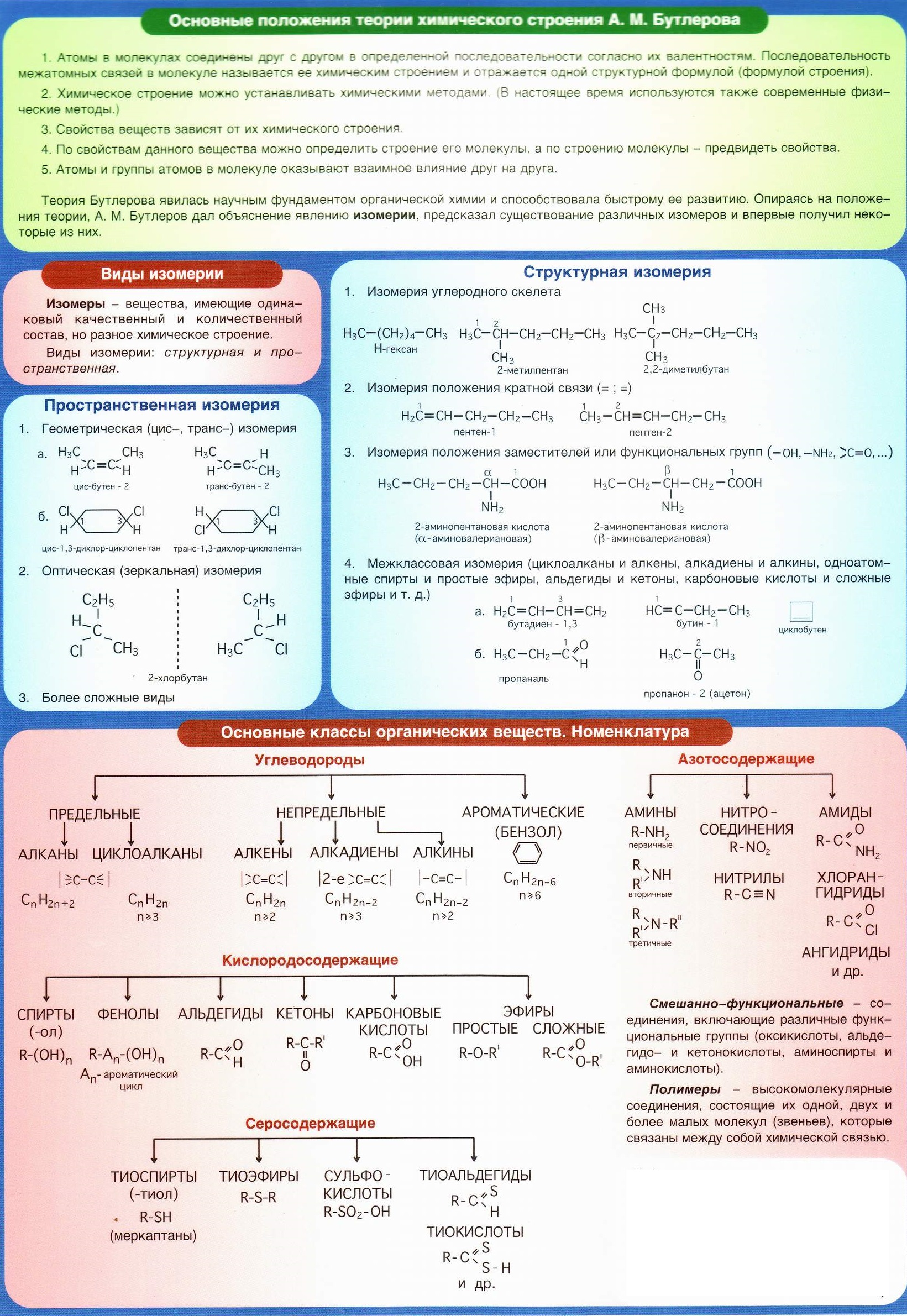
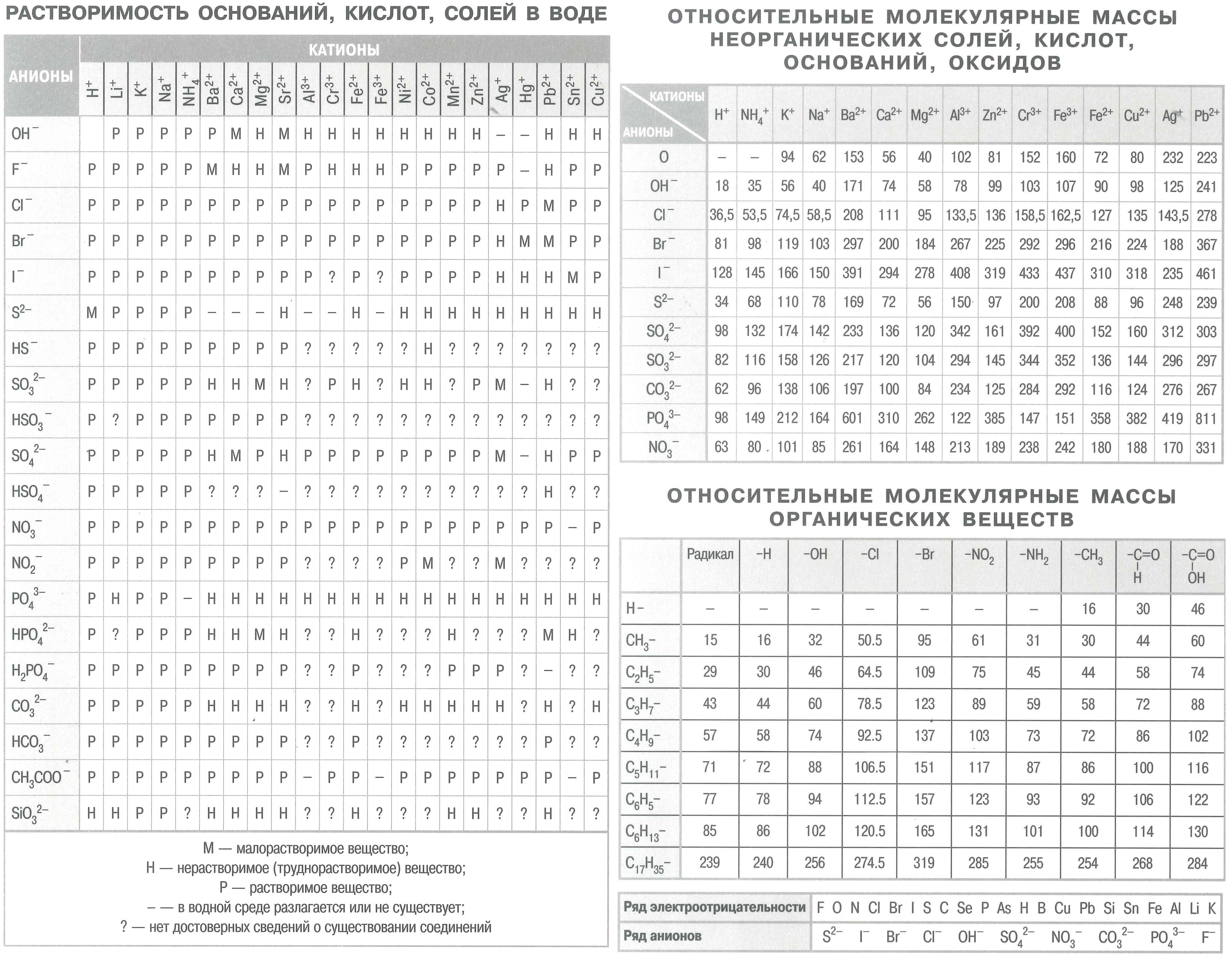
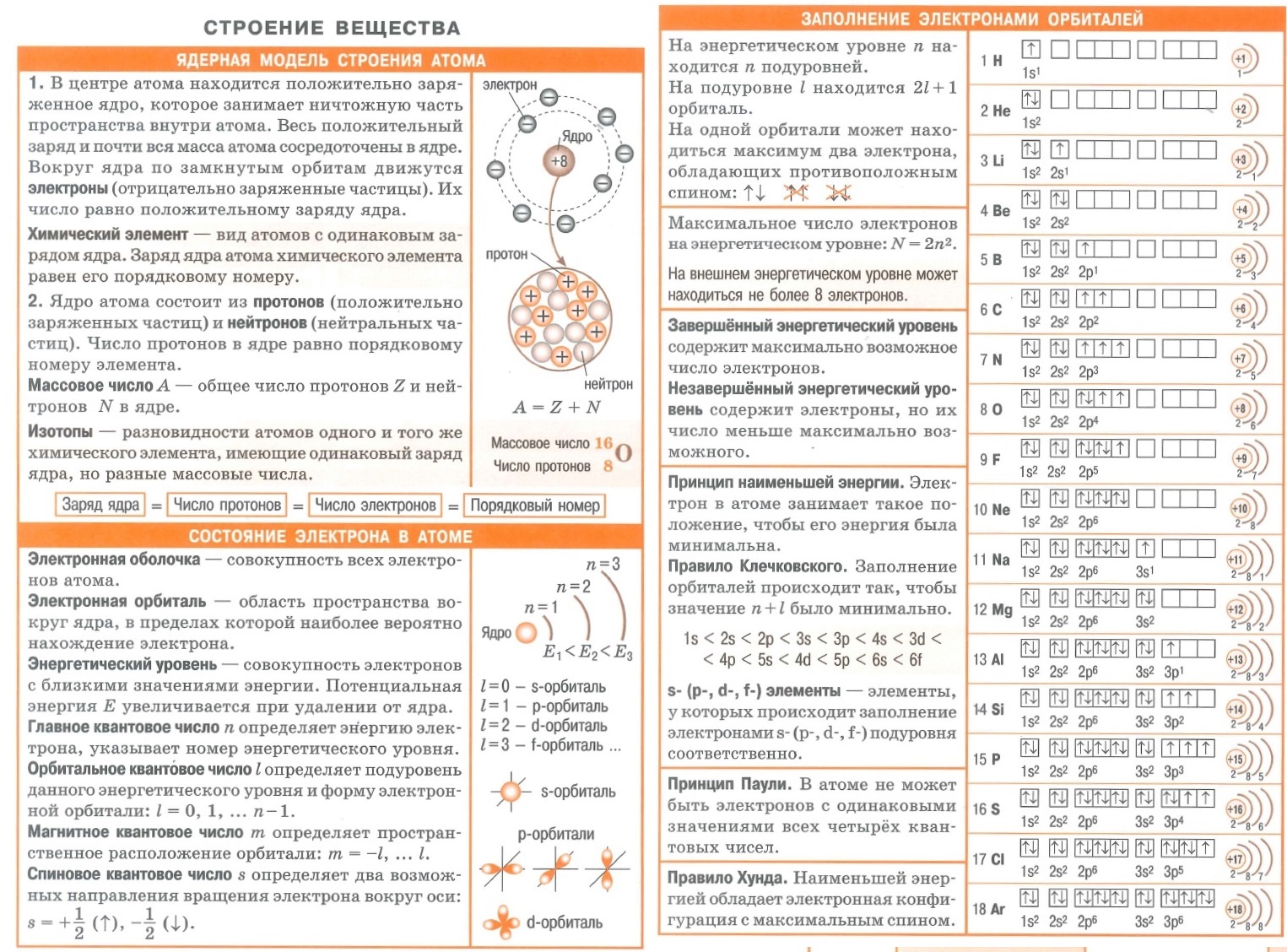
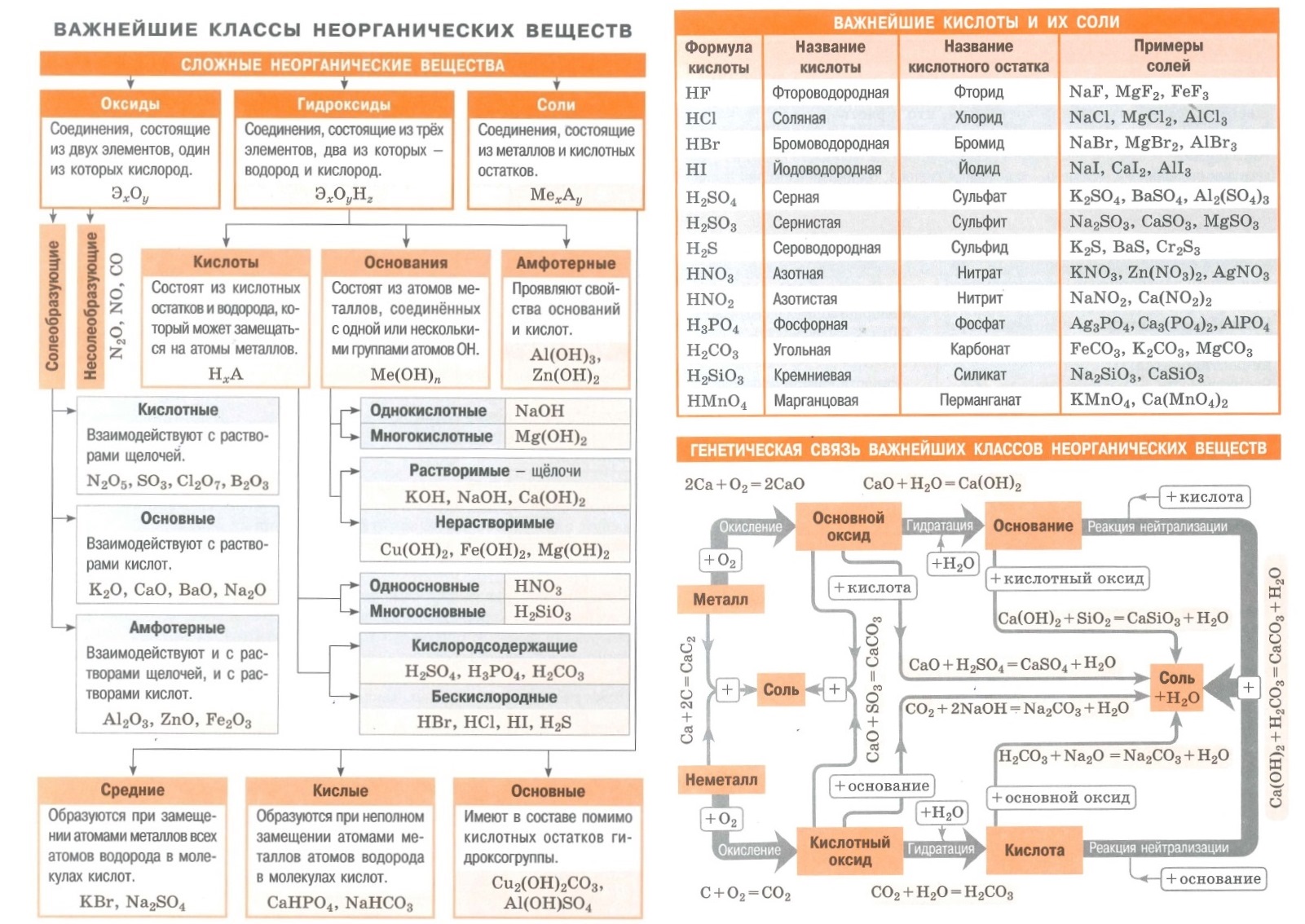
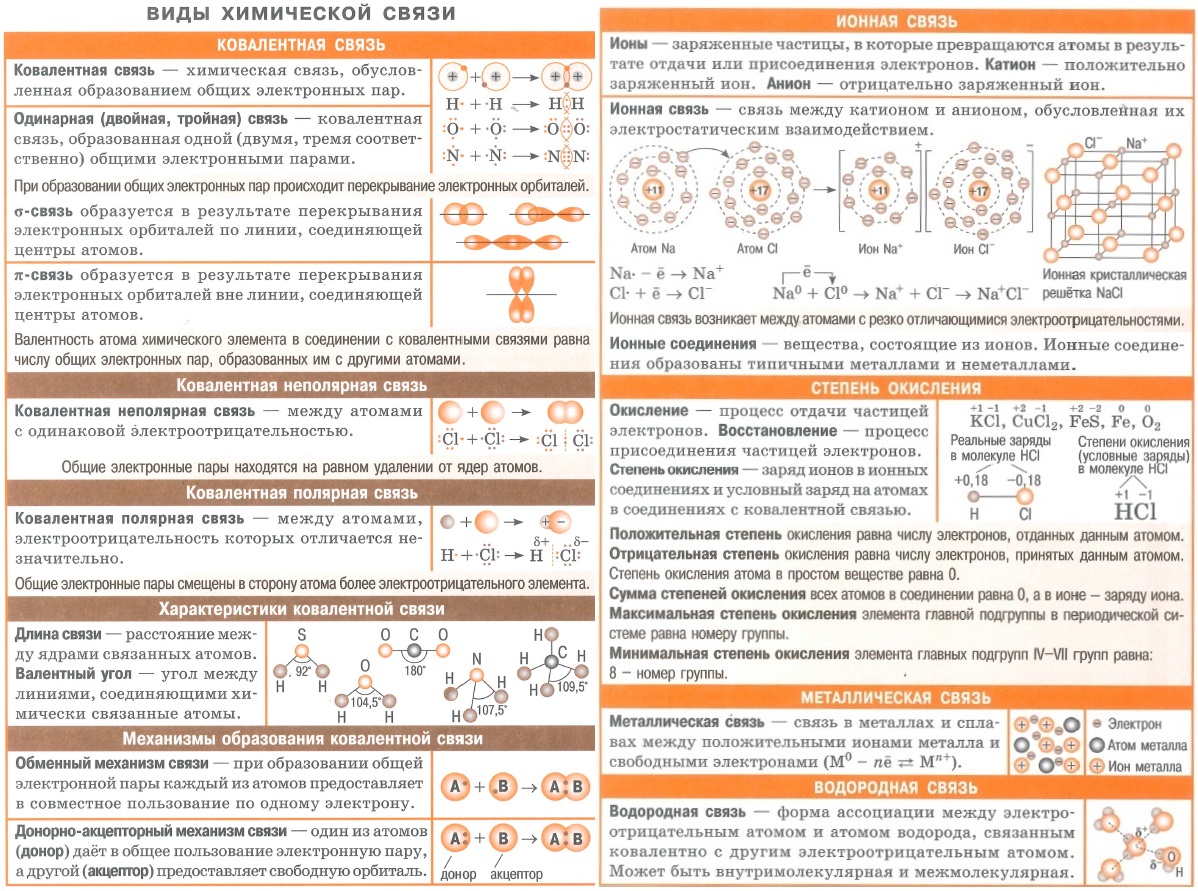
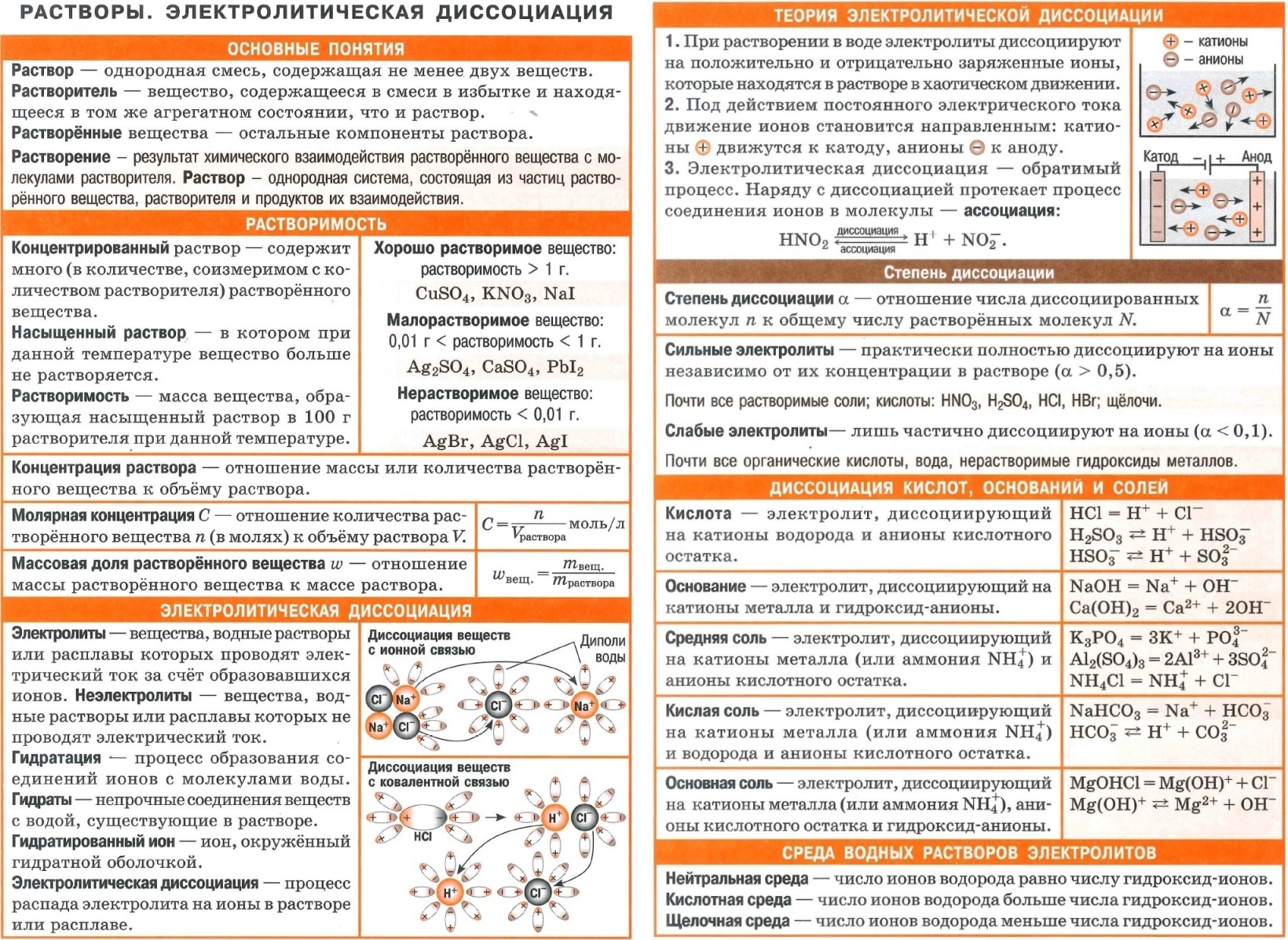
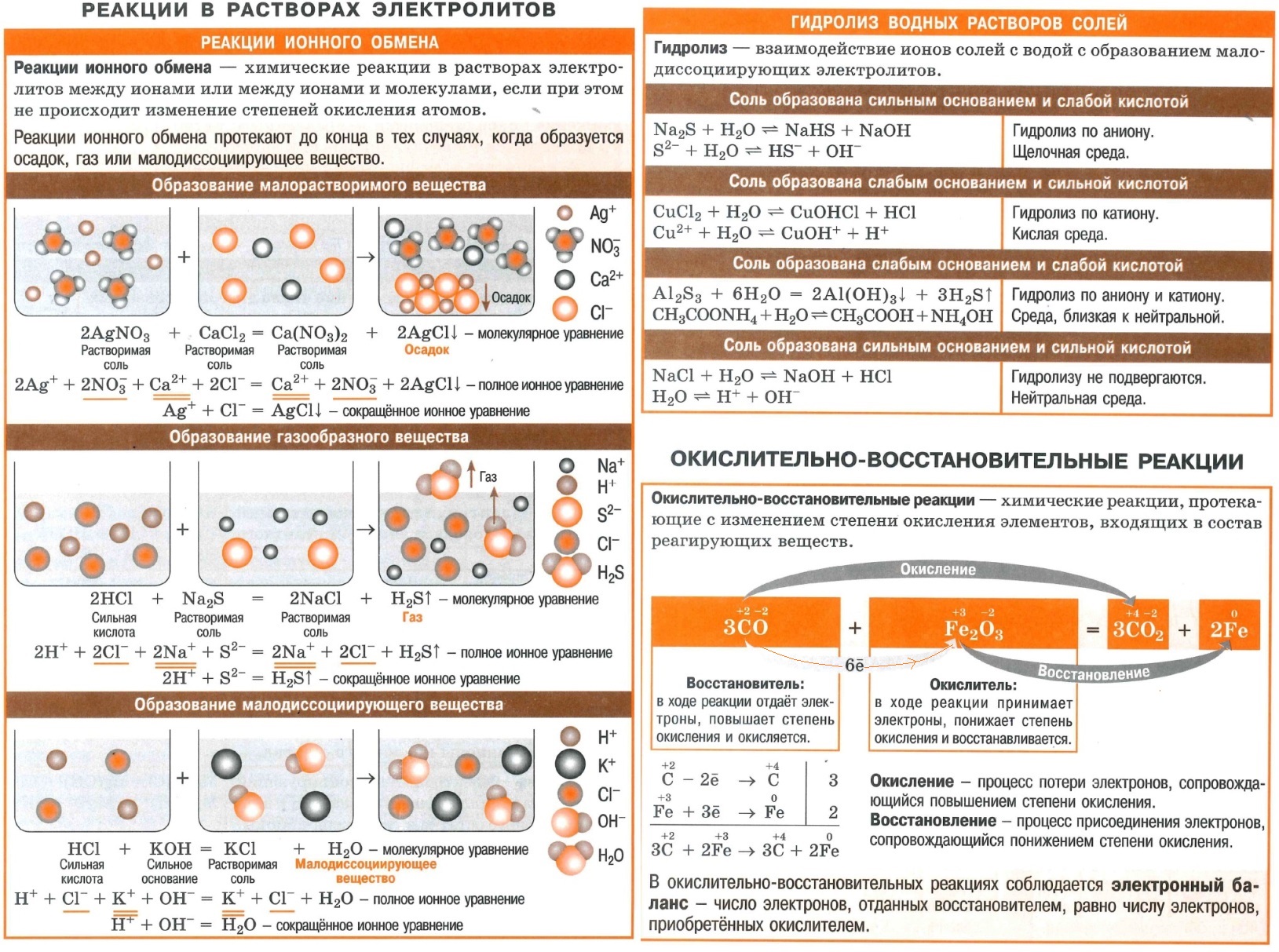
Полезные шпаргалки для егэ по химии
Проект Карла III Ребане и хорошей компании |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Техническая информация тут Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Шпаргалки по химии. Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
Уже который день моя статья «Тайны задач по химии? 1. Препарируем задачу ЕГЭ» вызывает нервные тики у вполне спокойных и уверенных в себе учителей. Не так они представляют себе решение задач. Им нужно, чтобы все было запутано и мало понятно, а на вопрос ученика: «Как решить задачу?» учитель, сделав умные глаза, отвечал бы: «Думай». А чем думать? Как думать? Куда думать? В какую сторону? Сие есть тайна великая! Однако, все тайное становится явным на вскрытии задач ЕГЭ. Вот и моя статья показала, какие приколы (фишки) для ЕГЭ по химии могут приготовить нашим детям сотрудники ФИПИ.
35-е задание ЕГЭ по химии (Задачи на нахождение формулы вещества) — одно из самых интересных заданий ЕГЭ. От этих задач веет немножко Копперфильдом: делаешь расчеты — проводишь анализ химических свойств — составляешь структурную формулу вещества. Но не все так однозначно и просто. Как показал анализ «вскрытия» одной из 35-х задач, ученик может столкнуться с очень накрученным (т.е. комбинированным) заданием, в которое авторы на основе нахождения формулы вещества умудрились втиснуть множество элементов из разных разделов алгоритмики и теоретической химии. Чтобы достойно справиться с решением 35-й задачи, а также других заданий ЕГЭ, нужно в процессе подготовки тщательно отрабатывать (шлифовать) каждый отдельно взятый алгоритмический элемент (алгоритмическую фишку): вначале — на простых заданиях, а затем — на комбинированных. Чем я и занимаюсь с учениками и планирую рассказывать об этом в своих статьях.
Авторская Система Задач по Химиинасчитывает несколько типов алгоритмов на вывод формулы вещества: по массовой доле, по продуктам сгорания, по стехиометрическим коэффициентам, по формуле в общем виде. Постепенно я буду рассказывать очень подробно о каждом алгоритме. Сегодня я хочу проработать специфику алгоритма Вывод формулы вещества по общей формуле класса. Итак, поехали!
Вывод формулы вещества по общей формуле класса
Алгоритм решения строится на логической схеме М(реал) = М(общ)
М(реал) — реальная молярная масса, которая рассчитывается по многим формулам. На фото я представляют основные формулы расчета реальной молярной массы
М(общ) — молярная масса вещества в общем виде, рассчитывается по общей формуле класса веществ. На фото можно увидеть примеры расчета молярной массы вещества в общем виде
В основе алгоритма задачи лежит составление уравнение с одним неизвестным, решение которого приводит к ответу. Потренируемся решать несложные задачи по этому алгоритму
Задача 1
Углеводород имеет формулу CnH2n-2. Определите n, если известно, что 0,8 моль углеводорода имеют массу 43,2 г.
Задача 2
Органическое вещество имеет формулу CnH2n+2О. Определите n, если известно, что 0,7 моль углеводорода имеют массу 32,2 г.
Задача 3
Масса одной молекулы ромбической серы равна 4,252•10-22 г. Рассчитайте число атомов в одной молекуле ромбической серы
Задача 4
Алкен массой 28 г содержит 3,01∙1023 молекул. Определите структурную формулу алкена, если известно, что при его окислении подкисленным раствором перманганата калия образуется ацетон.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии https://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Источник
МАОУ многопрофильный лицей №20
г. Ульяновск
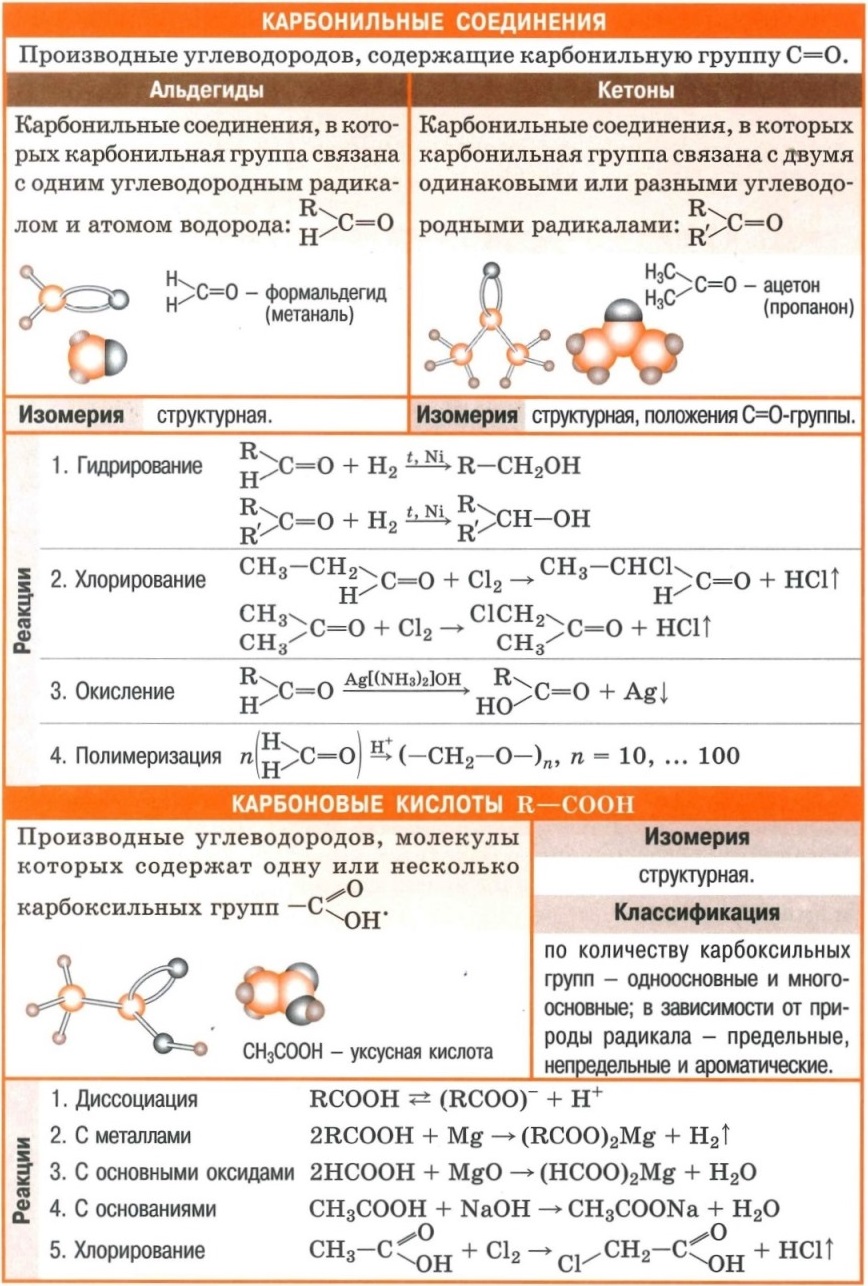
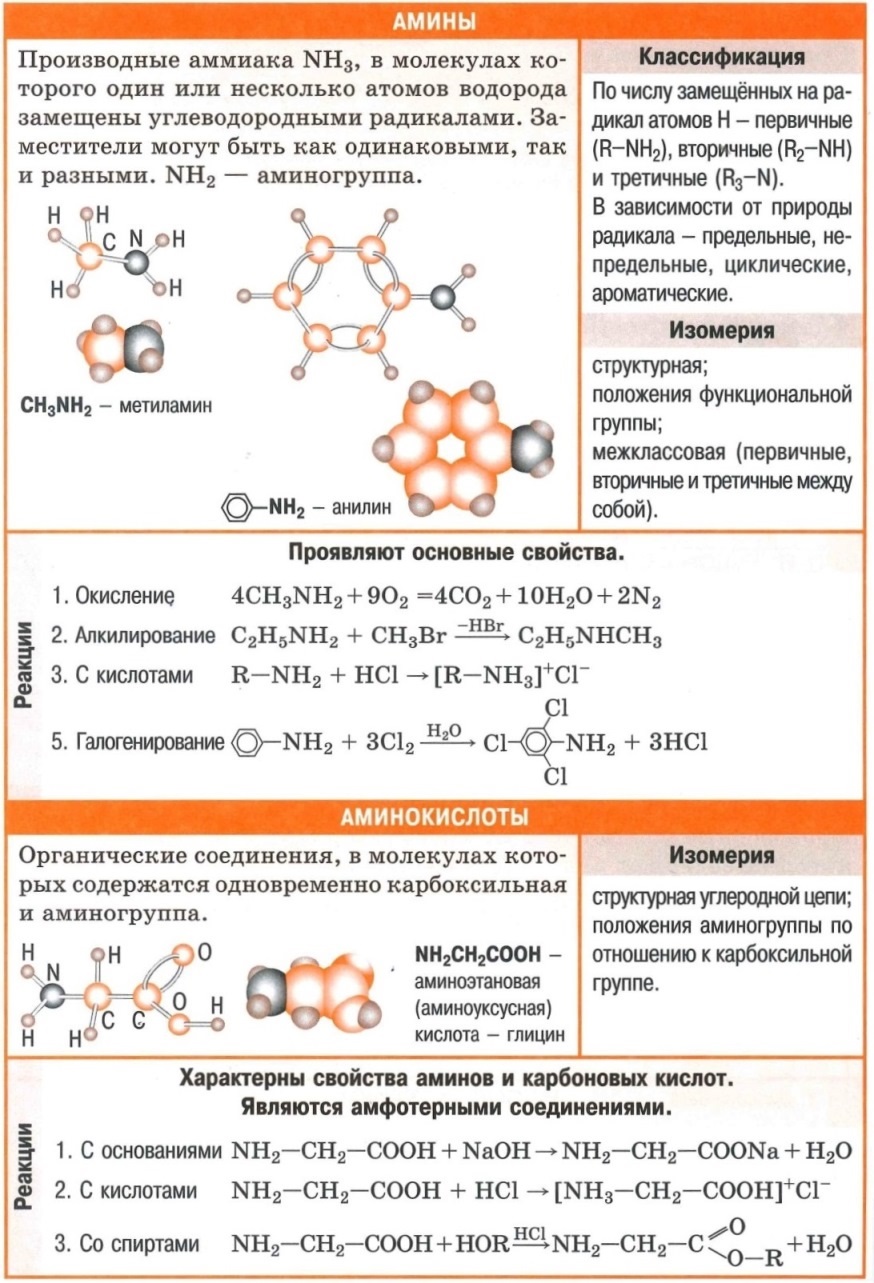
Краткая памятка-шпаргалка по органической химии
(для подготовки к ЕГЭ)
Составитель Селезнева Ольга Николаевна
учитель химии
высшей категории
Алканы: 1) замещение (R
, + Q, в 3 стадии) + галоген(не бромная вода); + азотная кислота
2) разложение
-крекинг (+ термический крекинг метана до ацетилена)
-дегидрирование
3) изомеризация (AlCl
3
) – c бутана
4) окисление на кат-ре (метан + О
2
до формальдегида, бутан до уксусной кислоты)
Алкены: 1) присоединение (по ионному механизму с образованием карбокатиона)
+ галоген, + галогеноводород, + вода (по правилу Марковникова для несимметричных алкенов)
2) полимеризация –R
3) окисление с KMnO
4
-в нейтральной среде при комнатной t до двухатомных спиртов
-при повышенной t и в кислой среде до карбоновых кислот (кетонов) или СО
2
(с разрывом цепи по двойной связи)
-в щелочной среде до солей
4) замещение по R при 500ºС
Алкины: 1) присоединение
+галоген, + галогеноводород, + вода (до этаналя и кетонов!)
димеризация до винилацетилена
тримеризация до бензола и его гомологов
2) окисление – ацетилен до щавелевой кислоты или её соли, остальные до карбоновых кислот и СО
2
(или солей)
3) замещение для НС≡СR + Na, + [Ag(NH
3
)
2
]OH , +[Cu(NH
3
)
2
]Cl
Арены: 1) замещение
+ галоген – в присутствии kat в кольце (монохлорбензол или 2,4,6-для гомологов); на свету для гомологов – в боковой
цепи (но не с бромной водой!)
+ азотная кислота
+ монохлоралкан (алкилирование)
2) р-ии присоединения
+ водород, + хлор на свету для бензола, + алкен (алкилирование в кислой среде)
3) р-ии окисления только для гомологов бензола до бензойной кислоты или солей.
Спирты: 1) + акт. Ме до алкоголятов (метилат,этилат) (О – Н)
2) + галогеноводород (С – О)
3) дегидратация до алкена (С – О) или до простого эфира (С – О и О – Н)
4) этерификация с карбоновыми кислотами и HNO
3
, H
2
SO
4
(О – Н)
5) окисление оксидом меди (II) до альдегида (первичный спирт) или кетона (вторичный спирт)
6) для многоатомных спиртов + Cu(OH)
2
Фенол: 1) + акт. Ме 2) + щёлочь в отличие от спиртов! 3) + бромная вода 4) + HNO
3
5) FeCl
3
6) + формальдегид;
легко окисляется.
Альдегиды: 1) окисление + Cu(OH)
2
;
+ [Ag(NH
3
)
2
]OH; + KMnO
4
2) присоединение + Н
2
; + спирт; + вода; + гидросульфит натрия
3) замещение по R
4) поликонденсация – формальдегид + фенол; 5) полимеризация для метаналя и этаналя
Карбоновые кислоты: 1) общие свойства кислот + Ме до Н; + МеО; + МеОН; + аммиак; + соли более слабых кислот (карб, силик,
фенолят)
2) + спирт (этерификация)
3) замещение по R с галогенами (не с бромной водой) 4) – Н
2
О → ангидрид
Муравьиная кислота + окисление + Cu(OH)
2
;
+ [Ag(NH
3
)
2
]OH; + KMnO
4
+ разложение до СО и Н
2
О в присутствии конц. серной кислоты
+Сl
2
→ HCl + CO
Олеиновая кислота +H
2
; +Br
2
; + KMnO
4
Щавелевая кислота под действием H
2
SO
4
разлагается до СО, СО
2
, Н
2
О
Амины (основные свойства): 1) + вода для низших аминов
2) + кислота, ZnCl
2
(кислая среда)
3) + монохлоралкан
4) + HNO
2
→ спирт + азот + вода (для низших аминов)
Анилин (очень слабое основание-нейтральная среда) + бромная вода, HNO
3
; легко окисляется
Аминокислоты (амфотерные свойства): 1) + кислота 2) + щёлочь +Ме до Н; + МеОН; + соль более слабых кислот; + аммиак
3) + спирт
4) + аминокислота → пептиды (поликонденсация)
Глюкоза (свойства альдегидов и многоатомных спиртов): 1) окисление + Cu(OH)
2
при нагревании
;
+[Ag(NH
3
)
2
]OH;
2) присоединение + водород
→ сорбит
3) + кислота карбоновая, ангидрид уксусной кислоты, серная; азотная 4) + спирт
5) брожение – спиртовое, молочнокислое, маслянокислое
6) качественная реакция на многоатомные спирты с Cu(OH)
2
без нагревания!
Сахароза: 1) + Н
2
О (гидролиз)
2) + Cu(OH)
2
как многоатомный спирт без нагревания! 3) + Cа(OH)
2
4) + кислота карбоновая, серная, азотная
Целлюлоза и крахмал: 1) + вода (гидролиз)
2) + карбоновая кислота или ангидрид, + серная кислота, + азотная кислота
3) крахмал + йод → синее окрашивание
Белки: 1) гидролиз; 2) ксантопротеиновая реакция с HNO
3
– жёлтое окрашивание; 3) биуретовая реакция с CuSO
4
и NaOH –
фиолетовое окрашивание
Список литературы:
1. Д.Д. Дзудцова, Л.Б. Бестаева «Окислительно-восстановительные реакции» — Москва,
«Дрофа», 2005
2. Н. Кузьменко, В. Еремин, В. Попков «Химия для школьников старших классов и
поступающих в вузы» — Москва, «Дрофа», 1999
3. Р.А. Лидин, Л. Ю. Аликберова «Справочник для старшеклассников и поступающих в вузы»
— Москва, «Аст-пресс»,2012
4. В.М. Потапов «Органическая химия» — Москва, «Просвещение», 1983
5. «Органическая химия» под редакцией Тюкавкиной – Москва, «Медицина». 1989
Источник
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Ой, как это мы позабыли о 9-х классах! Завтра уже ОГЭ по химии, а мы все ЕГЭ никак не выкашляем. Вот так всегда — ставка на сильного, впередиидущего, а все остальные просто подтягиваются.
Не торопитесь соглашаться и поддакивать. Задайтесь вопросом, как нужно изучать химию? Ежегодными кусками с повышением уровня сложности? Ребята дорогие, при таком подходе (методике) вы даже не поймете, какой предмет изучаете! Есть определенная структура (система) предмета. Ее и нужно изучать!
Я работаю репетитором более 30 лет и никогда не делила учеников на классы. Мы просто поднимаемся по ступеням системы химии или биологии. Скорость подъема (изучения предмета) определяется временем, которое имеется до защиты знаний (экзамена) — год, два или три (я не работаю с более ранним возрастом). В минигруппах учатся ребята из разных классов. Девятые и десятые классы тянутся за одиннадцатыми. Часто бывает наоборот, когда рулят девятые классы. Тогда у одиннадцатиклассников формируется стойкая мотивация на учебу — стыдно быть лузером среди мелких. Совместное участие в процессе изучения предмета и обмена опытом объединяет ребят (я бы даже сказала, духовно роднит), они начинают общаться и после занятий. Дружба продолжается во время учебы в ВУЗе, где более старшие опекают тех, кто поступил позже. Это замечательно! Ребенок, взрослея, не только изучает биологию и химию, адаптируясь к учебе в высшей школ, но и проходит стадию социализации среди более опытных сотоварищей.
Однако, я отвлеклась. Сегодня, за сутки до ОГЭ по химии, я хочу подарить своим ученикам и всем моим любимым читателям замечательную шпаргалку, которую легко можно пронести на экзамен!
— Как так?! — возмутятся в Рособрнадзоре!
— А вот так! — отвечу я.
Во-первых, это не обычная шпаргалка, а логическая схема, которая очень легко запоминается. Во-вторых, такую схему легко пронести в голове (здесь, уж точно, никакой детектор не обнаружит и камеры не просекут).
В качестве подарка хочу предложить схему изменения свойств элементов (и, соответственно, веществ) по Периодической Системе.
Основные понятия
1) Неметаллы (Н на схеме) — на внешнем (валентном) электронном уровне имеют 4-7 электронов, легко принимают электроны
С неметаллическими свойствами связаны кислотные свойства оксидов и кислородсодержащих кислот: чем активней неметалл, тем сильнее кислота (при одинаковой степени окисления элемента)
2) Металлы (М на схеме) — на внешнем (валентном) электронном уровне имеют 1-3 электрона, легко отдают электроны
С металлическими свойствами связаны основные свойства оксидов и гидроксидов: чем активней металл, тем сильнее основание.
3) Электроотрицательность (ЭО на схеме) — способность атома притягивать к себе электроны (и свои, и чужие).
Электроотрицательность тесно коррелирует (соотносится) с неметаллическими свойствами и окислительной активностью. Это хорошо видно на схеме.
4) Радиус атома (РА на схеме) — расстояние между атомным ядром и самой дальней орбитой электронов в электронной оболочке атома.
Радиус атома тесно коррелирует (соотносится) с металлическими свойствами и восстановительной активностью. Это видно на схеме.
С радиусом атома связаны кислотные свойства бескислородных кислот: чем больше радиус атома, тем сильнее бескислородная кислота (HF<HCl<HBr<HI)
5) Энергия ионизации (ЭИ на схеме) — количество энергии, которое атом должен поглотить для освобождения электрона; образуется ион-катион (+ заряжен положительно).
Энергия ионизации коррелирует с электроотрицательностью: чем больше электроотрицательность, тем больше энергия ионизации.
Энергия ионизации и радиус атома связаны обратной зависимостью: чем больше радиус атома, тем меньше энергия ионизации.
6) Сродство к электрону (СЭ на схеме) — энергия, которая выделяется или поглощается в процессе присоединения электрона к свободному атому; образуется ион-анион (- заряжен отрицательно).
Сродство к электрону численно равно, но противоположно по знаку энергии ионизации: чем выше энергия ионизации, тем ниже энергия сродства к электрону (и наоборот).
7) Окислительная активность (О на схеме) — способность отбирать электроны у других атомов.
Окислительная активность коррелирует с неметаллическими свойствами и электроотрицательностью. Это видно на схеме.
8) Восстановительная активность (В на схеме) — способность отдавать валентные электроны (электроны внешнего уровня) другим атомам.
Восстановительная активность коррелирует с металлическими свойствами и радиусом атома. Это хорошо видно на схеме.
Схема изменения свойств по ПСЭ
NB! Схема касается только элементов главных подгрупп!!!
Для желторотиков — смотрим только элементы, расположенные в розовых и желтых клеточках
Все, о чем было сказано в сегодняшней статье, относится к важнейшим понятиям химии. В ОГЭ это представлено в заданиях 2 и 16.
Вы хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками, многие из которых уже давно закончили ВУЗы и, работая врачами, спасают наши с вами жизни.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции (бесплатно). Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Репетитор по химии и биологии кбн В.Богунова
Источник