Полезные шпаргалки на егэ по химии

Проект Карла III Ребане и хорошей компании |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Техническая информация тут Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Шпаргалки по химии. Поделиться:
Поиск в инженерном справочнике DPVA. Введите свой запрос: Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
ЕГЭ по химии относится к числу экзаменов по выбору. В 2010 году химию сдавали 83 544 школьников. Особенно популярна она была в Республиках Тыва, Чечня и Башкортостан. Дисциплину сдают неслучайные люди.

Химия – обязательный предмет при поступлении на специальности: медицинские (лечебное дело, педиатрия, стоматология и фармация), химико-биологические (химия, биология) и аграрные (агрономия, агрохимия и агропочвоведение, агроэкология, защита растений, плодоовощеводство и виноградарство). Непрофильным предметом химия является при поступлении на геологические и некоторые технические направления.
Сколько баллов необходимо набрать по химии? Всё зависит от планов и амбиций абитуриента. Конкурс на медицинские специальности всегда был высоким. Стоматолог, фармацевт, хирург, офтальмолог, невропатолог, анестезиолог – профессии востребованные, престижные, высокооплачиваемые. Пожалуй, этим объясняется ежегодный высокий проходной балл на эти направления подготовки.
В 2010 году средний балл на медицинские специальности был равен 74,29 (средний балл за три предмета). Лидировали Московский государственный университет им. М.В. Ломоносова (94,3 баллов), Санкт-Петербургский государственный университет (84,2 баллов) и с 82,5 баллами Воронежская государственная медицинская академия им. Н.Н. Бурденко. Но шанс был и у тех, кто набрал меньше 70 баллов. Российский государственный медицинский университет (г. Москва), Иркутский государственный медицинский университет, Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова и еще порядка десяти медицинских вузов России принимали абитуриентов со средним баллом ниже 70.
В прошлую приёмную кампанию в аграрных вузах страны проходной балл не смог превысить порог в 70 баллов. Что касается таких специальностей, как химия и биология, наблюдается градация проходных баллов. В классических столичных вузах конкурс большой – баллы высокие (до 80 баллов). Менее престижные учебные заведения устанавливали порог и в 40 баллов (средний балл за три экзамена).
Структура экзаменационной работы
Экзаменационная работа по химии состоит из 3-х частей и включает 45 заданий.
Часть 1 (А1-А30) содержит 30 заданий. К каждому заданию даётся 4 варианта ответа, среди них только один правильный.
Пример: Основные свойства наиболее выражены у оксида
- бериллия
- магния
- алюминия
- калия
Часть 2 (В1-В10) включает 10 заданий, на которые надо дать краткий ответ в виде числа или последовательности цифр.
Пример: Какой объём (н. у.) сероводорода выделился при взаимодействии 0,3 моль сульфида железа (II) с избытком соляной кислоты?
Часть 3 (С1-С5) состоит из 5 наиболее сложных заданий, которые требуют полного (развёрнутого) ответа.
Пример: Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
Уровень сложности
Экзаменационная работа содержит разные по уровню сложности задания (базовый, повышенный и высокий).
| Части работы | Тип заданий | Уровень сложности заданий | Максимальный первичный балл |
| Часть 1 | С выбором ответа | Базовый | 30 |
| Часть 2 | С кратким ответом | Повышенный | 18 |
| Часть 3 | С развёрнутым ответом | Высокий | 18 |
Содержание экзаменационных заданий
В 2011 году контрольные измерительные материалы по химии будут содержать вопросы из следующих тематических блоков:
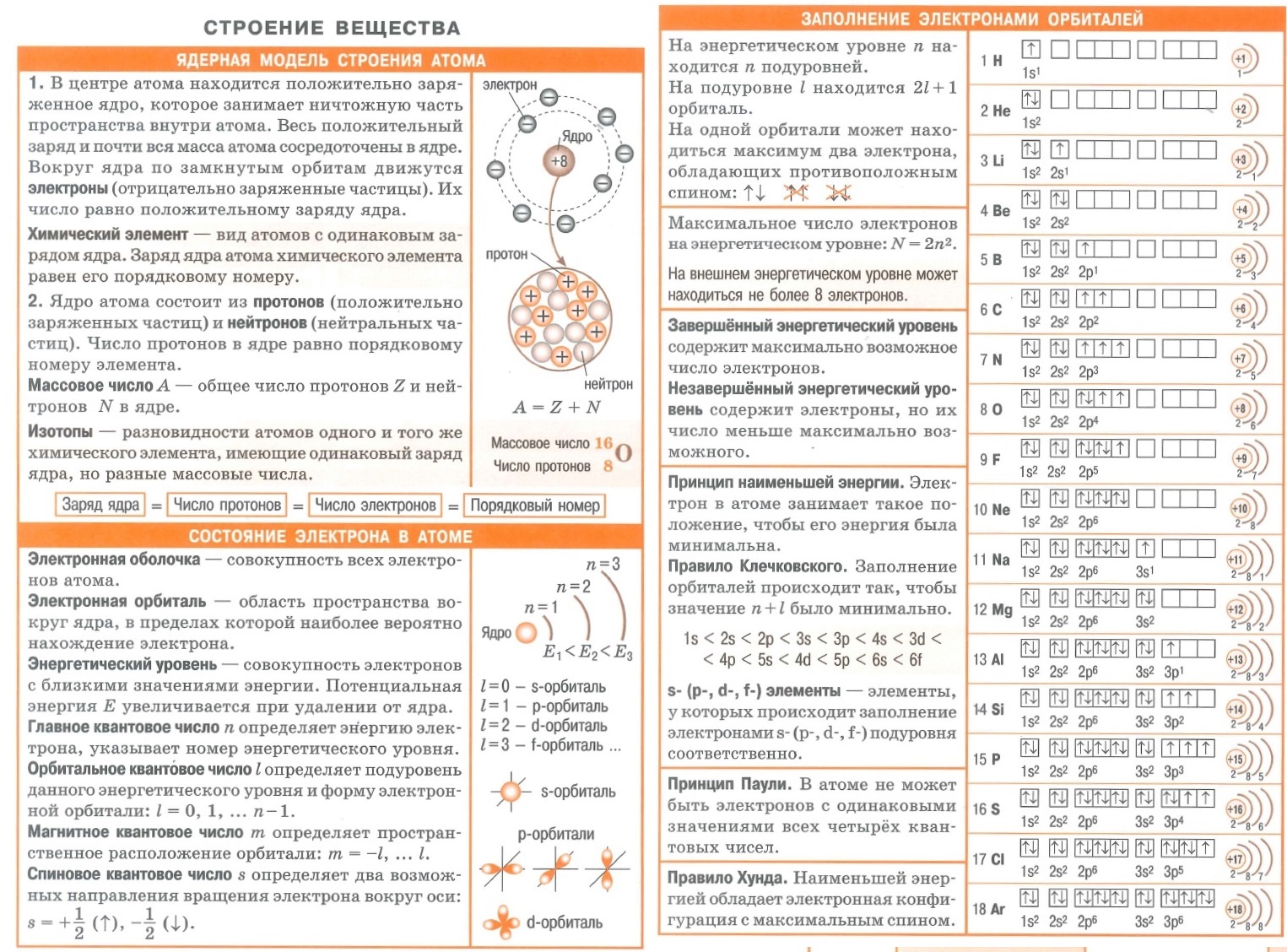
«Современные представления о строении атома» – одно задание базового уровня сложности;
«Периодический закон и периодическая система химических элементов Д.И. Менделеева» – три задания базового уровня;
«Химическая связь и строение вещества» – три задания базового уровня;
«Химическая реакция» –11 заданий (7 – базового , 3 – повышенного, 1 – высокого уровня);
«Неорганическая химия» – 9 заданий (6 – базового, 2 – повышенного, 1 – высокого уровня);
«Органическая химия» – 9 заданий (5 – базового, 3 – повышенного, 1 – высокого уровня);
«Экспериментальные основы химии. Общие способы получения веществ. Расчёты по химическим формулам и уравнениям» – три задания базового уровня;
«Общие представления о промышленных способах получения веществ» – одно задание базового уровня;
«Расчёты по химическим формулам и уравнениям» – пять заданий (1 – базового, 2 – повышенного, 2 – высокого уровня).
Время выполнения работы
Общая продолжительность экзаменационной работы составляет 3 часа (180 минут). Примерное время, отводимое на выполнение отдельных заданий, следующее:
- на решение каждого задания Части 1 (А) – 1-2 минуты;
- для каждого задания Части 2 (В) – порядка 5-7 минут;
- на выполнение одного задания Части 3 (С) – до 10 минут.
Как оцениваются задания и экзаменационная работа в целом?
За верное выполнение всех заданий экзаменационной работы можно максимально получить 66 первичных баллов.
Часть 1 — верное выполнение каждого задания базового уровня Части 1 (А) оценивается 1 баллом.
Часть 2 — в Части 2 верное выполнение заданий В1-В8 оценивается 2 баллами, заданий В9 и В10 – 1 баллом.
Часть 3 — задания Части 3 (с развёрнутым ответом) имеют различную степень сложности и предусматривают проверку от 2 до 5 элементов ответа. Наличие каждого элемента ответа оценивается в 1 балл, поэтому максимальная оценка верно выполненного задания составляет от 2 до 5 баллов (в зависимости от степени сложности задания).
Кто проверяет ЕГЭ?
Ответы на задания Части 1 (А) и Части 2 (В) обрабатываются автоматически после сканирования бланков ответов №1. Ответы к заданиям Части 3 проверяются экспертной комиссией в составе методистов, опытных учёных и преподавателей вузов. Проверка заданий Части 3 осуществляется на основе сравнения ответа выпускника с поэлементным анализом проведенного образца ответа.
Дополнительные материалы и оборудование
К каждому варианту экзаменационной работы прилагаются следующие материалы:
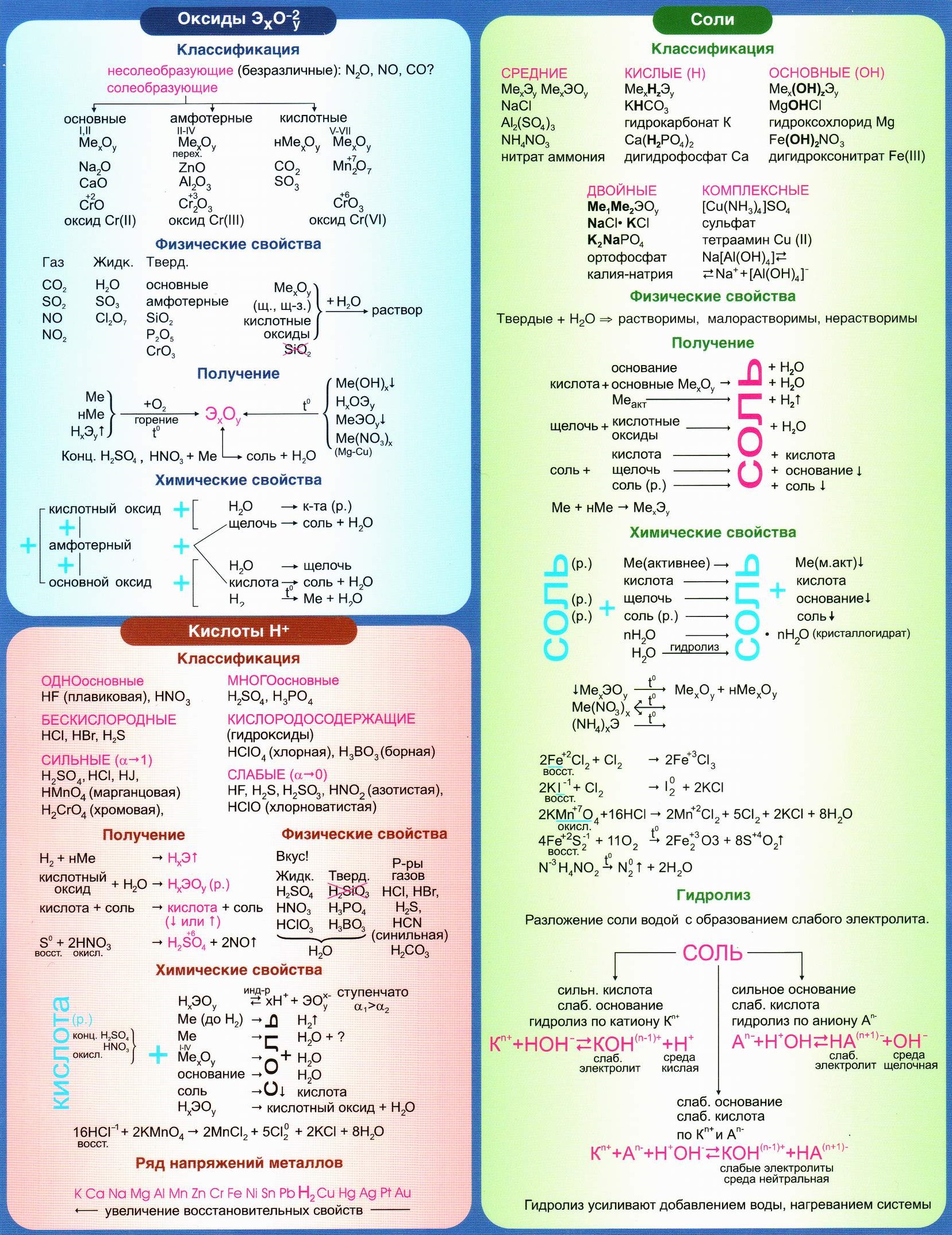
- периодическая система химических элементов Д.И. Менделеева;
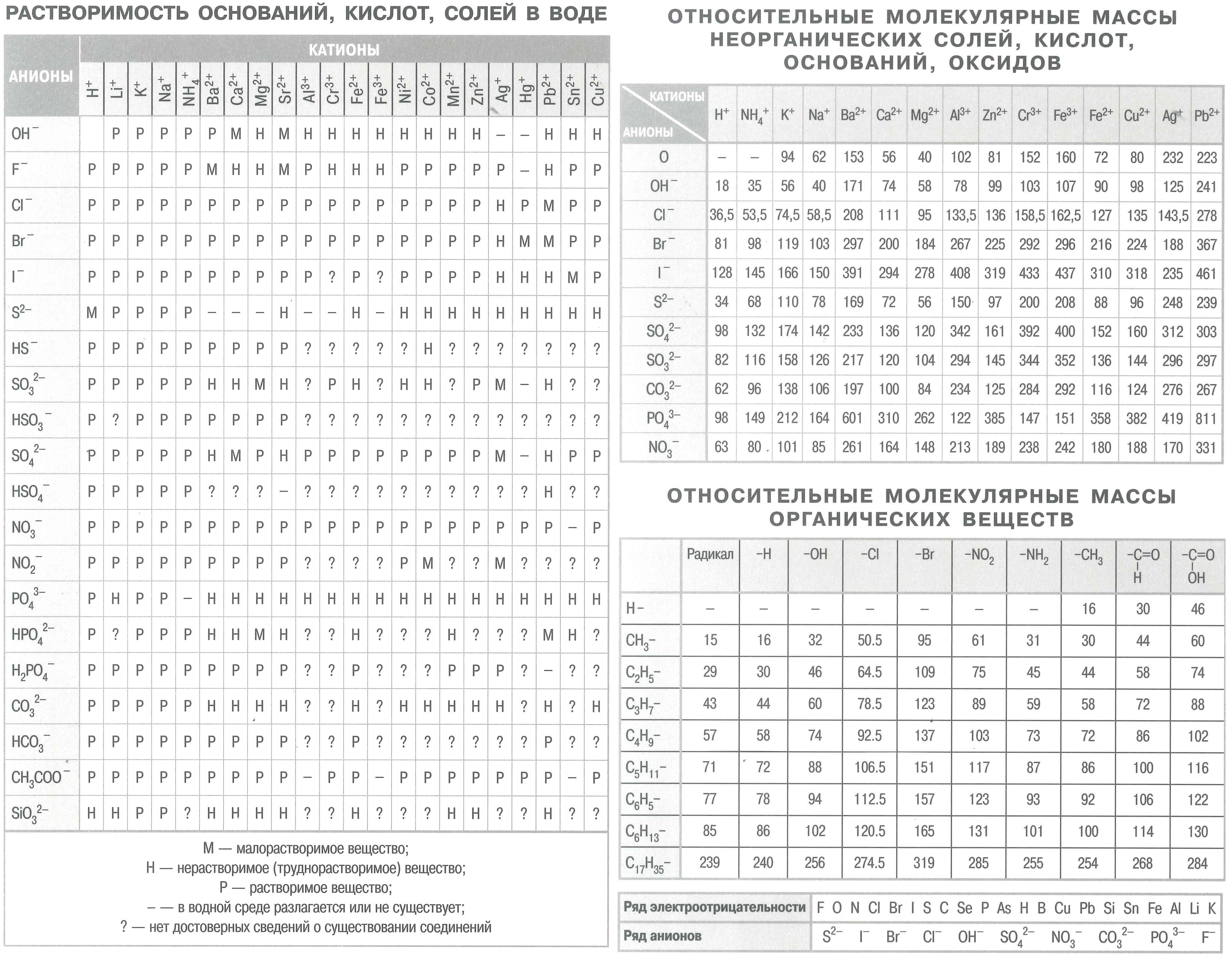
- таблица растворимости солей, кислот и оснований в воде;
- электрохимический ряд напряжений металлов;
- разрешается пользоваться непрограммируемым калькулятором.
Какие учебники и справочники использовать при подготовке к ЕГЭ-2011?
Существует перечень учебных пособий, разработанных с участием ФИПИ, специально для абитуриентов 2011 года.
Вот некоторые из них:
- Единый государственный экзамен 2011. Химия. Учебно-тренировочные материалы для подготовки учащихся / ФИПИ авторы-составители: Ю.Н. Медведев, А.А. Каверина, А.С. Корощенко – М.: Интеллект-Центр, 2010.
- ЕГЭ-2011: Химия / ФИПИ авторы-составители: А.С. Корощенко, М.Г. Снастина, Д.Ю. Добротин, А.А. Каверина – М.: Астрель, 2010.
- Государственная итоговая аттестация (по новой форме): 9 класс. Тематические тренировочные задания. Химия / ФИПИ авторы-составители: Д.Ю. Добротин, А.А. Каверина, Д.В. Болотов, Т.А. Боровских – М.: Эксмо, 2010.
Раздаточные материалы
В процессе подготовки к ЕГЭ выпускники могут воспользоваться официальными «помощниками». Это демонстрационные материалы ЕГЭ-2011, тесты из открытого сегмента Федерального банка тестовых заданий (https://www.fipi.ru/view) и он-лайн тесты (https://www.fipi.ru/view и https://www.edu.ru/index.php).
Минимальный балл
Составители контрольных измерительных материалов 2011 года (эксперты ФИПИ) предполагают, что, как и в предыдущем году, минимальное количество баллов ЕГЭ по химии будет равно 12 первичным баллам из 66 максимально возможных. В прошлом году 91,9 % экзаменуемых успешно прошли испытание. Средний балл по химии в 2010 году равнялся 55,1, а каждый трехсотый абитуриент набрал 100 баллов.
03.02.2011
Абсалямова Айгуль
www.moeobrazovanie.ru
Источник
МАОУ многопрофильный лицей №20
г. Ульяновск
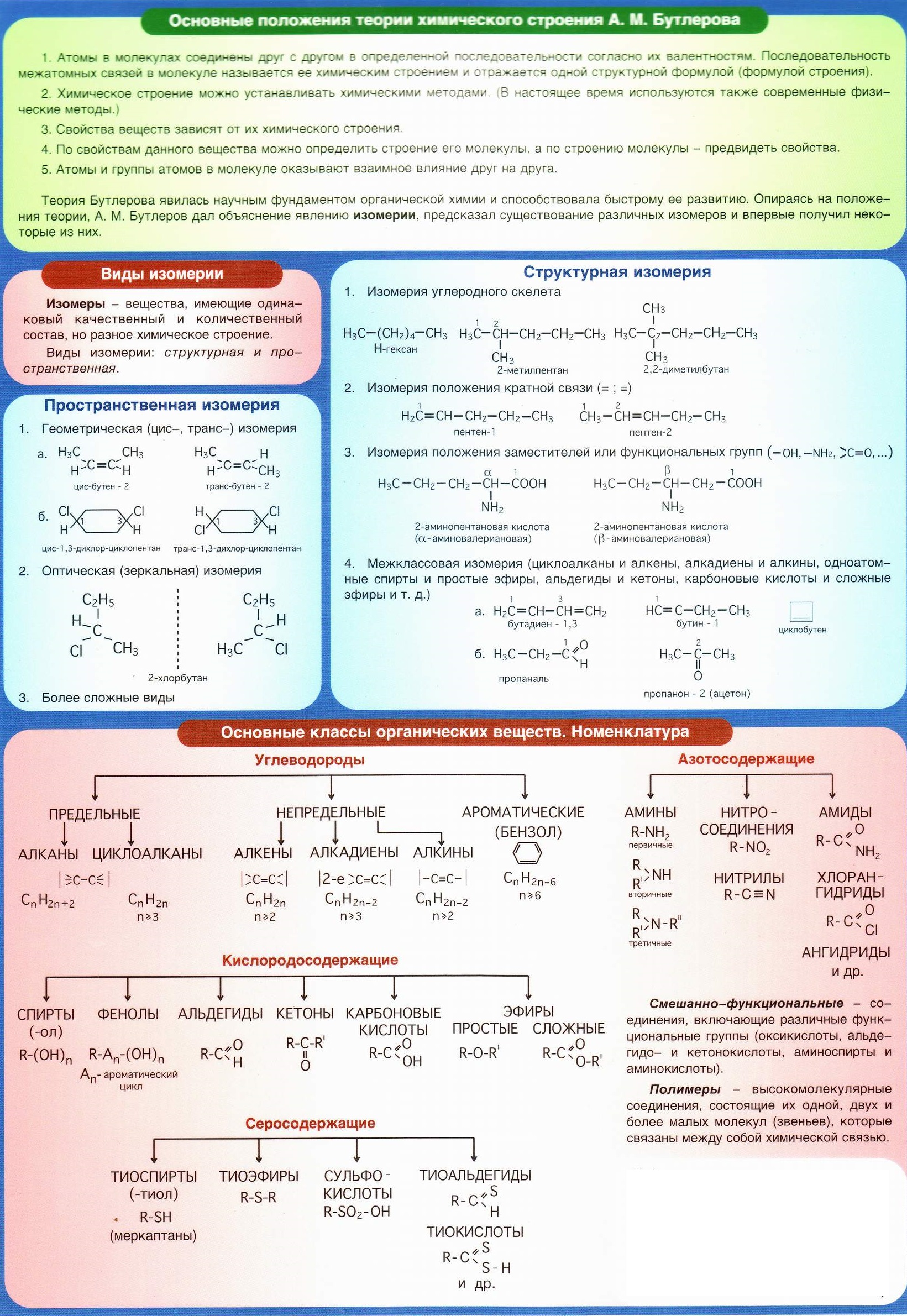
Краткая памятка-шпаргалка по органической химии
(для подготовки к ЕГЭ)
Составитель Селезнева Ольга Николаевна
учитель химии
высшей категории
Алканы: 1) замещение (R
, + Q, в 3 стадии) + галоген(не бромная вода); + азотная кислота
2) разложение
-крекинг (+ термический крекинг метана до ацетилена)
-дегидрирование
3) изомеризация (AlCl
3
) – c бутана
4) окисление на кат-ре (метан + О
2
до формальдегида, бутан до уксусной кислоты)
Алкены: 1) присоединение (по ионному механизму с образованием карбокатиона)
+ галоген, + галогеноводород, + вода (по правилу Марковникова для несимметричных алкенов)
2) полимеризация –R
3) окисление с KMnO
4
-в нейтральной среде при комнатной t до двухатомных спиртов
-при повышенной t и в кислой среде до карбоновых кислот (кетонов) или СО
2
(с разрывом цепи по двойной связи)
-в щелочной среде до солей
4) замещение по R при 500ºС
Алкины: 1) присоединение
+галоген, + галогеноводород, + вода (до этаналя и кетонов!)
димеризация до винилацетилена
тримеризация до бензола и его гомологов
2) окисление – ацетилен до щавелевой кислоты или её соли, остальные до карбоновых кислот и СО
2
(или солей)
3) замещение для НС≡СR + Na, + [Ag(NH
3
)
2
]OH , +[Cu(NH
3
)
2
]Cl
Арены: 1) замещение
+ галоген – в присутствии kat в кольце (монохлорбензол или 2,4,6-для гомологов); на свету для гомологов – в боковой
цепи (но не с бромной водой!)
+ азотная кислота
+ монохлоралкан (алкилирование)
2) р-ии присоединения
+ водород, + хлор на свету для бензола, + алкен (алкилирование в кислой среде)
3) р-ии окисления только для гомологов бензола до бензойной кислоты или солей.
Спирты: 1) + акт. Ме до алкоголятов (метилат,этилат) (О – Н)
2) + галогеноводород (С – О)
3) дегидратация до алкена (С – О) или до простого эфира (С – О и О – Н)
4) этерификация с карбоновыми кислотами и HNO
3
, H
2
SO
4
(О – Н)
5) окисление оксидом меди (II) до альдегида (первичный спирт) или кетона (вторичный спирт)
6) для многоатомных спиртов + Cu(OH)
2
Фенол: 1) + акт. Ме 2) + щёлочь в отличие от спиртов! 3) + бромная вода 4) + HNO
3
5) FeCl
3
6) + формальдегид;
легко окисляется.
Альдегиды: 1) окисление + Cu(OH)
2
;
+ [Ag(NH
3
)
2
]OH; + KMnO
4
2) присоединение + Н
2
; + спирт; + вода; + гидросульфит натрия
3) замещение по R
4) поликонденсация – формальдегид + фенол; 5) полимеризация для метаналя и этаналя
Карбоновые кислоты: 1) общие свойства кислот + Ме до Н; + МеО; + МеОН; + аммиак; + соли более слабых кислот (карб, силик,
фенолят)
2) + спирт (этерификация)
3) замещение по R с галогенами (не с бромной водой) 4) – Н
2
О → ангидрид
Муравьиная кислота + окисление + Cu(OH)
2
;
+ [Ag(NH
3
)
2
]OH; + KMnO
4
+ разложение до СО и Н
2
О в присутствии конц. серной кислоты
+Сl
2
→ HCl + CO
Олеиновая кислота +H
2
; +Br
2
; + KMnO
4
Щавелевая кислота под действием H
2
SO
4
разлагается до СО, СО
2
, Н
2
О
Амины (основные свойства): 1) + вода для низших аминов
2) + кислота, ZnCl
2
(кислая среда)
3) + монохлоралкан
4) + HNO
2
→ спирт + азот + вода (для низших аминов)
Анилин (очень слабое основание-нейтральная среда) + бромная вода, HNO
3
; легко окисляется
Аминокислоты (амфотерные свойства): 1) + кислота 2) + щёлочь +Ме до Н; + МеОН; + соль более слабых кислот; + аммиак
3) + спирт
4) + аминокислота → пептиды (поликонденсация)
Глюкоза (свойства альдегидов и многоатомных спиртов): 1) окисление + Cu(OH)
2
при нагревании
;
+[Ag(NH
3
)
2
]OH;
2) присоединение + водород
→ сорбит
3) + кислота карбоновая, ангидрид уксусной кислоты, серная; азотная 4) + спирт
5) брожение – спиртовое, молочнокислое, маслянокислое
6) качественная реакция на многоатомные спирты с Cu(OH)
2
без нагревания!
Сахароза: 1) + Н
2
О (гидролиз)
2) + Cu(OH)
2
как многоатомный спирт без нагревания! 3) + Cа(OH)
2
4) + кислота карбоновая, серная, азотная
Целлюлоза и крахмал: 1) + вода (гидролиз)
2) + карбоновая кислота или ангидрид, + серная кислота, + азотная кислота
3) крахмал + йод → синее окрашивание
Белки: 1) гидролиз; 2) ксантопротеиновая реакция с HNO
3
– жёлтое окрашивание; 3) биуретовая реакция с CuSO
4
и NaOH –
фиолетовое окрашивание
Список литературы:
1. Д.Д. Дзудцова, Л.Б. Бестаева «Окислительно-восстановительные реакции» — Москва,
«Дрофа», 2005
2. Н. Кузьменко, В. Еремин, В. Попков «Химия для школьников старших классов и
поступающих в вузы» — Москва, «Дрофа», 1999
3. Р.А. Лидин, Л. Ю. Аликберова «Справочник для старшеклассников и поступающих в вузы»
— Москва, «Аст-пресс»,2012
4. В.М. Потапов «Органическая химия» — Москва, «Просвещение», 1983
5. «Органическая химия» под редакцией Тюкавкиной – Москва, «Медицина». 1989
Источник
Скоро все будет в одном месте)
Лови чек-лист продуктивности 
Как им пользоваться: Распечатай чек-лист и повесь его над своим столом/вклей в тетрадь для подготовки к химии
Распечатай чек-лист и повесь его над своим столом/вклей в тетрадь для подготовки к химии Уверенно закрашивай те дни, и те недели, в которые ты учил(а) химию
Уверенно закрашивай те дни, и те недели, в которые ты учил(а) химию Визуально наблюдай за своим прогрессом и хвали себя
Визуально наблюдай за своим прогрессом и хвали себя И обязательно придумай себе доп-мотивации!
И обязательно придумай себе доп-мотивации!
ПРИМЕР ИСПОЛЬЗОВАНИЯ ЧЕК-ЛИСТА: ШАГ 1: поставь себе цели. Цель может быть и в одну строчку: «Буду заниматься химией 3 раза в неделю», а может быть и длиннее (по хештегу #мастер_менделеевой можешь почитать какую декларацию заполняют наши ученики)
ШАГ 1: поставь себе цели. Цель может быть и в одну строчку: «Буду заниматься химией 3 раза в неделю», а может быть и длиннее (по хештегу #мастер_менделеевой можешь почитать какую декларацию заполняют наши ученики) ШАГ 2: обязательно придумай себе вознаграждение! Пообещал(а) заниматься химией 3 раза в неделю? Обещание выполнено? Тогда смело закрась зеленым цветом неделю в чек-листе (2ая страница) и порадуй себя шоколадкой/часом игры на компьютере/прогулкой с друзьями/походом в кино. Бонус ты выбираешь сам(а) для себя!
ШАГ 2: обязательно придумай себе вознаграждение! Пообещал(а) заниматься химией 3 раза в неделю? Обещание выполнено? Тогда смело закрась зеленым цветом неделю в чек-листе (2ая страница) и порадуй себя шоколадкой/часом игры на компьютере/прогулкой с друзьями/походом в кино. Бонус ты выбираешь сам(а) для себя!
НАБЛЮДАЙ ВИЗУАЛЬНО ЗА СВОИМ ПРОГРЕССОМ И НЕ УПУСКАЙ ВРЕМЯ ВПУСТУЮ
МЕТОДИЧКА ПО РЕШЕНИЮ 27-28-29 ЗАДАНИЙ ЕГЭ
 Эта методичка объяснит тебе простым языком как решать 27-29 задачи
Эта методичка объяснит тебе простым языком как решать 27-29 задачи
В нашем проекте их справедливо называют кладбищем баллов, потому что множество ребят на экзамене допускают там ошибки 
Самое крутое, что химии в этих задачах на самом деле меньше чем математики!
Покажем тебе как использовать в основном математику и базовое понимание химических величин
В этом документе мы постарались весело и понятно объяснить самые простые способы решения таких задачек 
+ чек-лист для подготовки к ЕГЭ на год вперед СОХРАНЯЕШЬ — РАСПЕЧАТЫВАЕШЬ — УЧИШЬ МАТЕРИАЛ В ПРАВИЛЬНОМ ПОРЯДКЕ — СДАЕШЬ НА 90+
СОХРАНЯЕШЬ — РАСПЕЧАТЫВАЕШЬ — УЧИШЬ МАТЕРИАЛ В ПРАВИЛЬНОМ ПОРЯДКЕ — СДАЕШЬ НА 90+
Разобрали задания первой части ЕГЭ по химии.
__________________________________  Преподаватель-супергерой: Елена Капитан
Преподаватель-супергерой: Елена Капитан
— окончила киевский национальный университет
— педагогический стаж с 2003
— репетиторская деятельность с 2008
+ любима всеми нашими мастерами — вам она тоже понравится!
Разобрали типы связей и кристаллические решетки 
ВЫХОД РЕАКЦИИ: решение задач 
Тема: ВСЕ О МЕТАЛЛУРГИИ
Что разобрали:  Понятие металлургии
Понятие металлургии  Общие способы получения металлов
Общие способы получения металлов  Практика по 26 заданию ЕГЭ
Практика по 26 заданию ЕГЭ
Тема: Классификация органических веществ
 На этом вебинаре тебя ждет:
На этом вебинаре тебя ждет:
— Общие формулы каждого класса органических веществ (понадобится при решении 35 задачи)
— Практика по 11 заданию ЕГЭ
КАЧЕСТВЕННЫЕ РЕАКЦИИ В НЕОРГАНИЧЕСКОЙ ХИМИИ Что тебя ждет?
Что тебя ждет?
— качественный анализ на экзамене
— таблица растворимости — твоя шпаргалка?
— практика по 25 заданию
8 И 9 ЗАДАНИЕ: сложности и лайфхаки
Что тебя ждет на вебе: Лайфхаки, которые помогут упростить решения этих заданий
Лайфхаки, которые помогут упростить решения этих заданий  + будет много практики! Да да, будем повторять неорганику
+ будет много практики! Да да, будем повторять неорганику
Краткий обзор хим. свойств простых веществ
На этом вебинаре ты узнаешь:
— химические свойства всех простых веществ
— все исключения и особенности
— практику по неорганичсекой химии
Тема: ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Что разбираем: Химическое равновесие, факторы и примеры решения заданий ЕГЭ
Химическое равновесие, факторы и примеры решения заданий ЕГЭ
Тема: 34 ЗАДАЧА: основные типы
 Что разберем:
Что разберем:
Каждое действие и принцип решения
Практика по заданиям из прошлых лет
Тема: КАК ПОДГОТОВИТЬСЯ К ЕГЭ ЗА 4 МЕСЯЦА?
Тема: 10 лайфхаков для подготовки к ЕГЭ по химии на 80+ баллов
Источник