Полезные таблицы по химии 8 класс

«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| Молярная масса | М | кг/моль, г/моль |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля | | Безразмерная |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | Безразмерная |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/моль |

2. Соотношения между единицами физических величин



3. Химические формулы в 8 классе

Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе

- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.

ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Важнейшие классы неорганических веществ

Воздух. Кислород. Горение

Конспект урока «Химия 8 класс. Все формулы и определения».
Следующая тема: «».
Источник
«Единственный путь, ведущий к знаниям, — это деятельность».
(Бернард Шоу)
Пусть зимний день с метелями
Мне навевает грусть.
Таблицу Менделеева
Я знаю наизусть!
Динамическая таблица Менделеева
Игра «Таблица Менделеева» — жми на картинку и играй!
Таблица с русскими и латинскими названиями химических элементов
ХЭ таблица.png
Portable Network Image Format
9.3 KB
Естественные семейства элементов
Зависимость свойств элементов от атомног
JPG Image
135.2 KB
Примеры составления молекулярных и структурных формул
Составление структурных формул 8 кл.gif
Graphic Interchange format
12.5 KB
Правила определения валентности
РАЗДАТОЧНЫЙ валентность 8 класс.doc
Microsoft Word Document
35.5 KB
Изменение цвета индикаторов в различных средах
Изменение окраски кислотно-основных инди
Microsoft Word Document
39.5 KB
Таблица растворимости
Таблица растворимости солей, кислот и ос
Microsoft Word Document
43.0 KB
Важнейшие классы неорганических соединений
Опорный конспект Классы неорган соед.doc
Microsoft Word Document
92.5 KB
Таблица с названиями кислот и их кислотных остатков
кислоты и остатки.doc
Microsoft Word Document
59.0 KB
Оксиды и соответствующие им гидроксиды
Раздаточный ОКСИДЫ 8 класс.doc
Microsoft Word Document
87.0 KB
Опорная схема Генетическая связь между классами неорганических соединений
Генетическая связь.jpg
JPG Image
110.5 KB
Опорная схема «Оксиды»
ОС Оксиды 8 кл.docx
Microsoft Word Document
88.0 KB
Опорная схема «Основания»
ОС Основания 8 кл.docx
Microsoft Word Document
76.5 KB
Опорная схема «Кислоты»
ОС Кислоты 8 кл.docx
Microsoft Word Document
60.1 KB
Определение степеней окисления
1.png
Portable Network Image Format
431.7 KB
Составление формул по с/о
2.png
Portable Network Image Format
383.1 KB
Опорная схема «П/гр Азота»
ОС пгр Азота.docx
Microsoft Word Document
81.8 KB
Опорная схема «Азот»
ОС Азот простое вещество.docx
Microsoft Word Document
62.9 KB
Опорная схема «Аммиак»
ОС Аммиак.docx
Microsoft Word Document
51.2 KB
ЭХ ряд активности металлов, таблица и закономерности
ПАМЯТКА ЭХ ряд Ме.doc
Microsoft Word Document
74.0 KB
ОЭО
Относительные электроотрицательности эле
Microsoft Word Document
43.5 KB
Металлы
доп мат-л по Ме.doc
Microsoft Word Document
2.0 MB
Тривиальные названия некоторых веществ
Кислоты и их кислотные остатки
Экзамен по химии за 10 класс
Экзамен ХИМИЯ за 10 класс.doc
Microsoft Word Document
58.5 KB
ВАЖНЕЙШИЕ альфа АМИНОКИСЛОТЫ.doc
Microsoft Word Document
44.0 KB
Онлайн тест для учащихся 10 и 11 класса
Интерактивный мультимедиа учебник по органической химии
Химия в таблицах и схемах 1
Хим в табл и сх1.zip
Compressed Archive in ZIP Format
1.3 MB
Химия в таблицах и схемах 2
Хим в табл и сх2.zip
Compressed Archive in ZIP Format
1.5 MB
Химия в таблицах и схемах
Хим в табл и сх1.zip
Compressed Archive in ZIP Format
1.3 MB
Краткая характеристика самостоятельных работ учащихся
Виды самостоятельных работ.docx
Microsoft Word Document
13.0 KB
Требования к оформлению реферата
Требования к оформлению реферата.doc
Microsoft Word Document
40.5 KB
Требования к оформлению презентаций
Требования к презентациям.doc
Microsoft Word Document
235.0 KB
Источник
Химия в таблицах и схемах, 8 класс, Ковалевская Н.Б., 2003.
Данное пособие отражает в сжатой и наглядной форме все основные разделы курса химии 8 класса, оформленные в виде таблиц и схем. Пособие может быть использовано учащимися для закрепления на уроках и при выполнении домашних заданий.
Настоящее пособие может дополнить любой учебник химии для 8 класса общеобразовательной школы.

Однородными называются смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь.
Неоднородными называются смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ, составляющие смесь.
В смеси сохраняются свойства составляющих их веществ компонентов.
На основании этих свойств выбирают рациональный способ разделения смесей.
Химический элемент — это вид атомов, характеризующийся определенным зарядом ядра, строением электронных оболочек. Число элементов ограничено, а их комбинации дают все многообразие веществ.
В природе (на Земле) установлено существование 89 различных химических элементов. Некоторые элементы получены искусственным путем с использованием ядерных реакторов. В настоящее время известно 110 хим. элементов.
Содержание
1. ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ
1.1 Вещество. Свойства веществ 3
1.2 Молекулы и атомы. Атомно-молекулярное учение 4
1.3 Чистые вещества и смеси. Способы разделения смесей 5
1.4 Физические и химические явления 6
1.5 Химический элемент 7
1.6 Химические символы (Знаки химических элементов) 8
1.7 Знакомство с символами и названиями элементов 9
1.8 Простые и сложные вещества. Аллотропия 10
1.9 Химические формулы 11
2. КОЛИЧЕСТВЕННЫЕ ОТНОШЕНИЯ В ХИМИИ
2.1 Относительная атомная масса 12
2.2 Относительная молекулярная масса 13
2.3 Закон постоянства состава 14
2.4 Массовые отношения 15
2.5 Массовая доля элемента 16
2.6 Вывод химической формулы вещества по известной массовой доле 17
2.7 Валентность 18
2.8 Составление химических формул бинарных соединений (по валентности элементов) 19
2.9 Химическое уравнение 20
2.10 Химические уравнения (Алгоритм составления химического уравнения) 21
2.11 Закон сохранения массы веществ 22
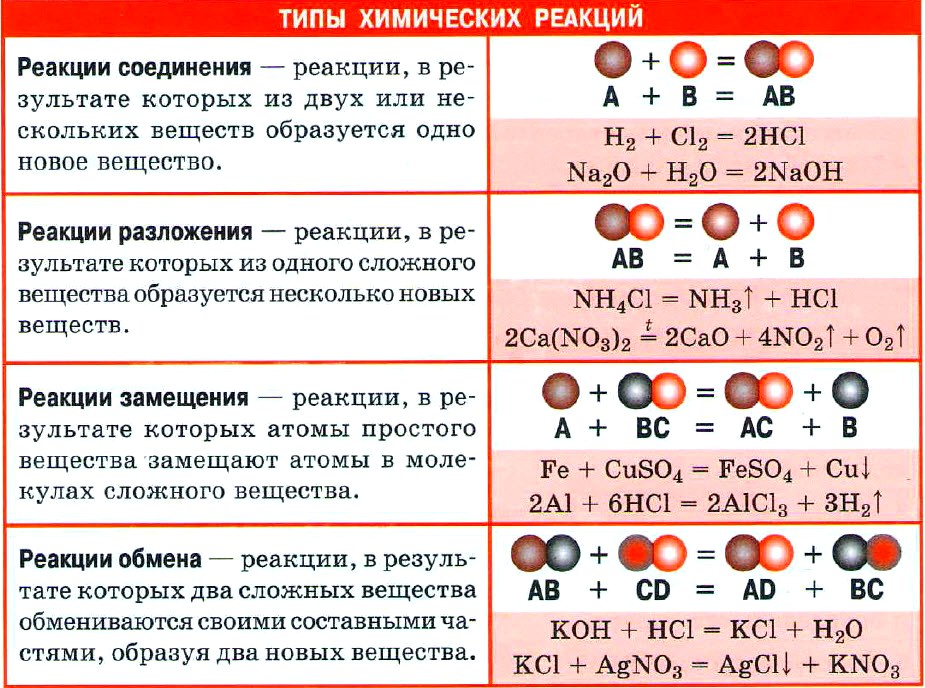
2.12 Типы химических реакций 23
2.13 Количество вещества. Моль 24
2.14 Число Авогадро 25
2.15 Молярная масса 26
2.16 Молярный объем. Закон Авогадро 27
2.17 Относительная плотность газов 28
2.18 Решение задач по химическим уравнениям 29
2.19 Тепловой эффект химической реакции 30
3. КИСЛОРОД
3.1 Кислород 31
3.2 Кислород. Химические свойства 32
3.3 Озон. (Аллотропная модификация кислорода) 33
3.4 Воздух 34
4. ВОДОРОД
4.1 Водород 35
4.2 Водород. Химические свойства 36
5. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
5.1 Оксиды 37
5.2 Оксиды. Химические свойства 38
5.3 Названия некоторых оксидов 39
5.4 Кислоты. Классификация 40
5.5 Названия кислот и солей 41
5.6 Кислоты. Химические свойства 42
5.7 Основания 43
5.8 Основания. Химические свойства 44
5.9 Соли 45
5.10 Соли. Химические свойства 46
5.11 Генетическая связь. (Связь между различными классами соединений) 47
6. ВОДА. ВОДНЫЕ РАСТВОРЫ
6.1 Вода 48
6.2 Аномалии воды 49
6.3 Вода-растворитель 50
6.4 Массовая доля растворенного вещества 51
6.5 Молярная концентрация растворенного вещества 52
6.6 Химические свойства воды 53
7. СТРОЕНИЕ АТОМА
7 1 Планетарная модель атома 54
7.2 Атомное ядро 55
7.3 Изотопы 56
7.4 Электрон 57
7.5 Движение электрона в атоме 58
7.6 Формы электронных орбиталей 59
7.7 Электронная оболочка атома 60
7.8 Электронная формула 61
7.9 Ядерные реакции 62
8. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
8.1 Периодический закон — фундамент всей химии 63
8.2 Периодическая система химических элементов Д.И.Менделеева 64
8.3 Числа периодической системы химических элементов Д.И.Менделеева 65
8.4 Изменение свойств элементов по основным направлениям системы 66
8.5 Звездность периодической системы 67
8.6 План характеристики химических элементов по периодической системе химических элементов Д.И.Менделеева 68
8.7 «Укрепители периодического закона» 69
8.8 Электронное строение атомов элементов II периода и свойства их высших оксидов и гидроксидов 70
9. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
9.1 Электроотрицательность 71
9.2 Электроотрицательность некоторых элементов 72
9.3 Ковалентная неполярная связь 73
9.4 Ковалентная полярная связь 74
9.5 Донорно-акцепторная (координационная) связь 75
9.6 Ионы 76
9.7 Ионная связь 77
9.8 Степень окисления 78
9.9 Окислительно-восстановительные реакции 79
9.10 Составление уравнений окислительно-восстановительных реакций (метод электронного баланса) 80
10. ПРИЛОЖЕНИЕ
10.1 Химические улыбки 81
10.2 Физические величины. Единицы измерения 82
10.3 Физические величины. Единицы измерения 83
10.4 Физические величины. Единицы измерения 84
10.5 Ряд электроотрицательности. Электрохимический ряд напряжений металлов 85
10.6 Периодическая система химических элементов Д.И.Менделеева (короткая форма) 86
10.7 Периодическая система химических элементов Д.И.Менделеева (длинная форма) 87
10.8 Периодическая система химических элементов Д.И.Менделеева (полудлинная форма) 88
10.9 Периодическая система химических элементов Д.И.Менделеева (лестничная форма) 89
10.10 Растворимость солей, кислот и оснований в воде 90
10.11 Условные обозначения 91
Литература 93.
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу Химия в таблицах и схемах, 8 класс, Ковалевская Н.Б., 2003 — fileskachat.com, быстрое и бесплатное скачивание.
Скачать djvu
Ниже можно купить эту книгу по лучшей цене со скидкой с доставкой по всей России.Купить эту книгу
Скачать книгу Химия в таблицах и схемах, 8 класс, Ковалевская Н.Б., 2003
— Яндекс Народ Диск.
Скачать книгу Химия в таблицах и схемах, 8 класс, Ковалевская Н.Б., 2003 — depositfiles.
Дата публикации: 14.08.2012 05:43 UTC
Теги:
учебник по химии :: химия :: Ковалевская :: 8 класс
Следующие учебники и книги:
- Химия, 11 класс, Профильный уровень, Еремин В.В., Кузьменко Н.Е., 2010
- Химия для гуманитариев, 10-11 класс, Ширшина Н.В., 2005
- Химия в таблицах, 8-11 класс, Насонова А.Е., 2000
- Химия в таблицах и схемах, 9 класс, Ковалевская Н.Б., 2007
Предыдущие статьи:
- Химия в таблицах и схемах, 10-11 класс, Ковалевская Н.Б., 2007
- Химия, 8 класс, Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю., 2005
- Полный комплект цветных таблиц по неорганической химии, Назарова Т.С., Куприянова Н.С., Кожевников Д.Н., 2010
- Органическая химия, 11 класс, Профильный уровень, Новошинский И.И., Новошинская Н.С., 2008
Источник
6
Атомы и молекулы. Атомно –
молекулярное учение. Вещества молекулярного и немолекулярного строения
§ 4, 13 читать, учить
определения
Ответить устно на вопросы
1- 10 стр. 25 и 8 – 12 стр. 37
7
Простые и сложные вещества.
Химический элемент
§ 5, 6 читать, учить
определения
Ответить устно на вопросы
11 – 13 и 14 — 15 стр. 25
8
Язык химии. Знаки
химических элементов. Относительная атомная масса
§ 7, 8 читать, учить
химические знаки (табл.2 стр. 24); отвечать на вопросы 16, 17, 18 (письм.)
стр. 25
9
Закон постоянства состава
веществ
§ 9 читать, учить
формулировку закона;
Ответить на вопросы 1, 2
(письм.), 3, 4 (письм), 5 (письм), 6 стр.31 – 32
10
Относительная молекулярная
масса. Химические формулы
§ 10 учить определения,
расчётные формулы; решить письм. задания 8, 9, 10, 11 стр 32
11
Массовая доля химического
элемента в соединении
Учить формулу для расчёта,
решить задачи в тетради
12 – 13
Валентность химических
элементов.
§ 11, 12 учить определения
и алгоритм;
Ответить на вопросы 1 – 3
(устно) и 4 – 7 (письм.) стр. 37.
Решить письм. задачи 1, 2
стр. 37
14
Закон сохранения массы
вещества. Химические уравнения
§ 14, 15 учить определения,
читать;
Ответить устно на вопросы 1
– 3 стр. 47
15
Классификация химических
реакций по числу и составу исходных и полученных веществ
§ 16 читать, учить
классификацию;
Ответить письменно на
вопросы 4 – 6 стр. 47
16
Моль – единица количества
вещества. Молярная масса
§ 17 учить формулы; решить
письменно 7 – 10 стр. 47
17
Решение расчётных задач по
химическим уравнениям
§ 17 читать стр. 45 – 47.
Решить задачи письм. 1, 2
стр. 48
Повторить § 1 – 17,
подготовиться к КР №1
18
Контрольная работа №1
Первоначальные химические понятия
Подготовить сообщение «Что
я знаю о кислороде»
19
Кислород, его общая
характеристика и нахождение в природе. Получение кислорода и его физические
свойства
§ 18, 19, 20 (стр. 55)
читать, учить, пересказывать, ответить на вопросы 1, 2 (письм.), 3 стр. 59
20
Химические свойства
кислорода. Оксиды. Применение. Круговорот кислорода в природе
§ 20, 21 читать, учить
свойства, ответить на вопросы 4, 5 (письм.), 6 (письм.), 7 (письм.), 8 – 10,
12, 11 (письм.) стр.60
Подготовиться к ПР №3 стр.
70 читать
21
Практическая работа №3
Получение и свойства кислорода
§ 20, 21 читать, учить
свойства, ответить на вопросы 4, 5 (письм.), 6 (письм.), 7 (письм.), 8 – 10,
12, 11 (письм.) стр.60
Решить задачи 1,2,3 стр. 60
22
Воздух и его состав. Защита
атмосферного воздуха от загрязнения.
§ 22 стр. 60 – 62 читать
пересказывать; ответить на вопросы 1 – 4 стр. 69
23
Горение и медленное окисление.
Тепловой эффект химических реакций
§ 22 стр. 62 – 64 учить и
читать,
§ 23, 24 ответить на
вопросы 5 – 13 (7 письм.) и решить задачи 1, 2 стр. 69
24
Водород, его общая
характеристика и нахождение в природе. Получение водорода и его физические
свойства
§ 25, 26, 27 (стр. 74)
читать, учить способы получения.
Ответить письм. 1 – 5 стр.
76
25
Химические свойства
водорода. Применение
§ 27 учить, ответить письм.
6 – 11 стр. 76 – 77
26
Повторение и обобщение по
темам «Кислород», «Водород»
Повторить § 18 – 27
Подготовить презентации о
воде (по темам)
27
Вода – растворитель.
Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде
§ 28 стр. 78 – 79
Ответить на вопросы 1 -3
стр. 81
28
Массовая доля растворённого
вещества
§ 28 стр. 80
Ответить на вопросы 4 – 6
стр. 81 и решить задачи 1 – 4 стр. 81
Подготовиться к ПР №4, стр.
88 читать
29
Практическая работа №4
Приготовление растворов с определённой массовой долей растворённого вещества
§ 28 стр. 80
Ответить на вопросы 4 – 6
стр. 81 и решить задачи 1 – 4 стр. 81
30
Вода. Анализ и синтез воды.
Вода в природе и способы её очистки.
§ 29 стр. 80 – 84 читать
31
Физические и химические
свойства воды
§ 29 учить свойства
Ответить на вопросы 1 – 7
(6,7 письм.) стр. 87 – 88 . Решить задачу стр. 88
Повторить § 18 – 29,
подготовиться к КР №2
32
Контрольная работа №2
«Кислород. Водород, Вода. Растворы»
Творческие задания по теме
«Кислород. Водород, Вода. Растворы»
33
Оксиды: классификация,
номенклатура, свойства оксидов, получение, применение
§ 30 учить
Вопросы 1 – 7 и задачи 1, 2
стр. 92 – 93 решить в тетради
34
Основания: классификация,
номенклатура, получение
§ 31 учить: ответить на
вопросы 1 – 4 стр. 99
35
Физические и химические
свойства оснований. Реакция нейтрализации
§ 31 учить; ответить на
вопросы 5 – 9 и решить задачи 1 — 4 стр. 99
36
Кислоты: классификация,
номенклатура, физические и химические свойства
§ 32 учить; решить 1 – 9
стр. 104 – 105 и задачи 1 – 2 стр. 105
37
Соли: классификация,
номенклатура, способы получения.
§ 33 учить, ответить 1 – 5
стр. 112
38
Физические и химические
свойства солей
§ 33 учить, ответить 6 – 10
стр. 112
39
Генетическая связь между
основными классами неорганических соединений
§ 33 стр. 110 – 111 учить;
решить задачи 1,2 стр. 112
Подготовиться к ПР №5 стр.
114, читать
40
Практическая работа №5
Решение экспериментальных задач по теме «Основные классы неорганических
соединений»
Повторить § 30 – 33 ,
подготовиться к КР №3
41
Контрольная работа №3
«Классы неорганических соединений»
Творческие задания по теме
«Значение неорганических веществ в жизни человека»
42
Классификация химических
элементов. Амфотерные соединения.
§ 34 учить, ответить на
вопросы 1 – 3 стр. 122
43
Периодический закон Д. И.
Менделеева
§ 35 читать, пересказывать,
ответить на вопросы 4 – 5, решить задачу стр. 122
44
Периодическая таблица
химических элементов. Группы и периоды
§ 36 учить, ответить на вопросы
1 4 стр. 125
45
Строение атома. Состав
атомных ядер. Изотопы. Химический элемент
§ 37 стр. 125 – 128 учить,
ответить на вопросы 1 – 2 стр. 138
46
Строение электронных
оболочек атомов первых 20 элементов периодической системы Д. И. Менделеева.
Современная формулировка периодического закона
§ 37 учить
47
Состояние электронов в
атомах. Периодическое изменение свойств химических элементов в периодах и
главных подгруппах
§ 37 учить, ответить на
вопросы 3 — 6 стр. 138
48
Значение периодического
закона. Жизнь и деятельность Д. И. Менделеева
§ 37 повторить, 38, 39
читать, пересказывать
49
Повторение и обобщение по
теме «Периодический закон и
Периодическая система химических элементов Д. И. Менделеева. Строение атома»
§ 34 – 37 повторить
50
Электроотрицательность
химических элементов
§ 40 учить и читать,
ответить 1 стр. 145
51
Химическая связь
Ковалентная связь. Полярная и неполярная ковалентные связи
§ 41 стр.141 – 144 учить
52
Ионная связь
§ 41 стр. 144 – 145 учить,
решить 2 – 7 стр. 145
53
Кристаллические решётки
§ 42 учить определения,
ответить на вопросы 1 – 4 стр. 152
54
Валентность и степень
окисления. Правила определения степеней окисления элементов
§ 42 стр. 148 – 150 и § 43,
ответить на 5 – 9 стр. 152, решить задачи 1 и 2
55 — 56
Окислительно – восстановительные
реакции
Учить конспект в тетради,
решить задания в тетради
57
Повторение и обобщение по
теме «Химическая связь. Строение вещества»
§ 34 — 43 повторить, подготовиться к КР №4
<

