Полезные таблицы по химии к егэ
Муниципальное автономное общеобразовательное учреждение
средняя общеобразовательная школа №9
Таблицы и схемы по химии
при подготовке к ЕГЭ.
учитель химии МАОУ СОШ №9
Моргунов Н.М.
ст. Темиргоевская 2018г.
Используемая литература:
Н.Е.Кузьменко, В.В.Ерёмин, В.А.Попков «Начала химии». Со-временный курс для поступающих в ВУЗы. – М.: «Экзамен», 2001г.
А.И.Артёменко «Органическая химия». Учебник для строит. спец. вузов. – М.: «Высшая школа», 1994г.
А.С.Егоров, Г.Х.Аминова «Экспресс-курс неорганической и органической химии. Для поступающих в ВУЗы.» — Ростов-на-Дону: «Феникс», 2002г.
А.С.Егоров «Химия в 400-х вопросах и ответах». (Пособие для учащихся и абитуриентов). Ростов-на-Дону: «Феникс», 2001 г.
А.С.Егоров «Как сдать ЕГЭ по химии на 100 баллов». – Ростов-на-Дону: «Феникс», 2003г.
И.А.Фрейфельд «Общая химия». Пособие для абитуриентов и старшеклассников. М.: «Московский лицей», 1996г.
И.И.Новошинский, Н.С.Новошинская «Переходные элементы и их соединения». Пособие для старшеклассников и абитуриентов. – Краснодар: «Советская Кубань», 2006г.
И.И.Новошинский, Н.С.Новошинская «Органическая химия 11 класс». Учебник для общеобразовательных учреждений. – М.: «Образование», 2005г.
И.И.Новошинский, Н.С.Новошинская «Химия. 10 класс». Учебник для общеобразовательных учреждений. – М.: «Оникс» «Мир и Образование», 2006г.
Тепловой эффект растворения веществ:
газы CO2
кислоты H2SO4
щёлочи NaOH
соли:
CuSO4
FeSO4
ZnSO4
Na2SO4
Na2CO3
AlCl3
AgNO3
NaCl
NaNO3
KNO2
NH4NO3
CuSO4 . 5H2O FeSO4 . 7H2O } купоросы
ZnSO4 . 7H2O
Na2SO4 . 10H2O кристаллическая сода
Na2СO3 . 10H2O Глауберова соль
AlCl3. 6H2O
Тепловой эффект химических реакций:
экзотермические (+Q)
эндотермические (-Q)
а) соединения искл. N2 + O2 = 2NO — Q
б) нейтрализации
в) замещения
г) овр
а) разложения
искл. 2H2O2 = 2H2O + O2 + Q
(NH4)2Cr2O7 = Cr2O3 + N2 +4H2O + Q
б) гидролиз
Механизмы органических реакций:
радикальный
( hv, t, H2O2 )
ионный
1) Замещение:
а) предельных у/в
hv
CH4 + Cl2 → CH3Cl + HCl
б) непредельных у/в ( у α-атома) – р-ция Львова.
hv
CH2=CH-CH3 + Cl2 → CH2=CH-CH3 + HCl
в) ароматических у/в ( в боковой цепи)
t, hv
С6Н5-СН2-СН3 + Cl2 → C6H5-CHCl-CH3 + HCl
2) Присоединение : a) непредельных у/в против правила Марковникова:
H2 O 2
CH3 –CH =CH2 + HCl → CH3-CH2-CH2Cl
б) ароматических у/в
hv
C6H6 + Cl2 → C6H6Cl6
3) Полимеризация:
n СН2=СН2 → (-СН2-СН2- )n
4) Горение, окисление:
t
CH4 + 2O2 → CO2 + 2H2O
1) Замещение в бензольном кольце:
FeCl3 , t
С6Н6 + Cl2 → C6H5Cl + HCl
H2SO4k, t
C6H6 + HNO3 → C6H5-NO2 + H2O
2) Присоединение непредельных у/в ( кроме гидрирования):
CH3-CH=CH2 + HCl → CH3-CHCl-CH3
3) Полимеризация ( в присутствии катализатора)
O2
n CH2=CH2 → (-CH2-CH2)n
H2SO4
n CH2=C-CH=CH2 → (-CH2-C=CH-CH2-)n
| |
CH3 CH3
Периодический закон и периодическая система.
№ периода = числу электронных слоёв
№ группы = числу (внешних) валентных электронов (для главных подгрупп)
F He
электроотрицательность радиус атомов ув.
ув.
Fr
F
неметаллические и металлические и
окислительные свойства восстановительные свойства
ув.
ув.
Fr
HF – самое устойчивое летучее водородное соединение
HClO4 – самая сильная кислородсодержащая кислота
FrOH HI – самая сильная бескислородная кислота
самое сильное основание
внешние
s, p — элементы
валентные внешние S и предвнешние d ( кроме Zn, Cd, Hg ) d — элементы
электроны
внешние S , предвнешние d и 3-й снаружи f f — элементы
Химическое равновесие.
υпрям.=υобратн.( при данных условиях )
υ пр [HI]2
H2 + I2( пар) 2 HI( г)Kравн = не зависит от концентрации и kat.
υ обр [H2] . [I2] ( зависит от t и природы реагиру-
ющих веществ )
[CO]
CO2 (г) + C(т) 2CO(г)Kравн = закон действующих масс для обратимых реакций
[CO2]
Факторы смещения хим. равновесия ( принцип Ле-Шателье) :
1) Изменение концентрации ( кроме тв. веществ) : ув. исх.
ув. продукты
2) Изменение температуры : ув. t — Q
ум. t +Q
3) Изменение давления ( для газов ) : 4 моль 2 моль
ум. Р ув. Р
H2 (Г) + I2 (Г) 2HI(Г) => P не влияет
2 моль 2 моль
Катализатор на смещение равновесия не влияет.
Смещение равновесия при диссоциации:
разбавление , связывание одного из ионов → (н: NaOH )
CH3COOH C H3COO- + H+
← ув. концентрации, введение одноимённых ионов (н: CH3COONa, HCl)
Смещение равновесия гидролиза:
Разбавление, нагревание, связывание одного из ионов → ( н: NH4Cl => H+ )
Na2CO3 + HOH NaHCO3 + NaOH – Q
CO32 − + HOH HCO3- + OH-
← ув. концентрации, охлаждение, введение одноимённых ионов (н: K2S => OH- )
Скорость химической реакции.
нет поверхности раздела гомогенные υ = +_ Δν / v . Δτ
ж + ж, г + г
υср. = +_ Δ С / Δ τ ; [ моль/ л . сек ]
Реакции –
есть
т + ж, т + г, т + т гетерогенные υ = +_ Δ ν / s . Δτ
Факторы, влияющие на скорость:
1) Концентрация : чем > С , тем > υ
ув.Р ( для газов) ум. V
N2 + 3H2 = 2NH3υ = k [ N2 ] . [ H2 ] 3 — кинетическое уравнение закона действующих масс
4Al (тв.)+ 3O2(г) = 2Al2O3υ = k [ O2 ] 3 — твёрдые не входят ( для гетерогенных реакций)
Fe порошок + CuSO4 10% > Fe порошок + CuSO4 4% > Fe гвоздь + CuSO4 4%
2) Температура: при повышении t на каждые 100υ ув. в 2-4 раза ( правило Вант-Гоффа ) , т.к.
ув. число активных частиц (способных преодолеть Еакт. )
t2 — t 1
10
υ t2 = γ
υ t1
3) Природа реагирующих веществ:
а) υ в-в с ионной и полярной ков. связью > υ в-в с неполярной или малополярной связью
н/о Zn + HCl = > органические Zn + CH3COOH =
б) активность металлов Mg + HCl > Fe + HCl неметаллов F2 + H2 > I2 + H2
K + H2O > Li + H2O (взрыв)
4) Площадь поверхности(для твёрдых в-в) : чем > S поверн. , тем > υ
Al порошок горит, Al ложка нет
5) Катализатор – в-во, изменяющее υ , но не расходующееся + Еакт. ↓
— ↑
NO(г)
гомогенный ( kat и реаг. в-ва в одной фазе ) 2SO2 (г) + O2 (Г) = 2SO3 катализ Fe(ТВ.)
гетерогенный (в разных) N2 (Г) + 3H2 (Г) = 2NH3
каталитические яды
В-ва
промоторы
Разрушение комплексных солей и солей анионного типа:
1) Na2[ Zn(OH)4 ] + 2HCl нед. = Zn(OH)2 ↓ + 2NaCl + 2H2O
Na2[ Zn(OH)4 ] + 4HCl изб. = 2ZnCl2 +2NaCl + 4H2O
2) Na3[ Al(OH)6 ] + 3H2CO3 = Al(OH)3↓ + 3NaHCO3 + 3H2O
Na3[ Al(OH)6 ] + 3H2S = Al(OH)3↓ + 3NaHS + 3H2O
3) Na[ Al(OH)4 ] + CO2 = Al(OH)3 ↓ + NaHCO3
Na3[ Cr(OH)6 ] + 3SO2 = Cr(OH)3↓ + 3NaHSO3
4) Na3[ Cr(OH)6 ] + FeCl3 = Cr(OH)3↓ + Fe(OH)3 + 3NaCl
3Na[Al(OH)4 ] + AlCl3 = 4Al(OH)3↓ + 3NaCl
5) 2Na3[ Cr(OH)6 ] + 3H2O2 = 2Na2CrO4 + 2NaOH + 8H2O
t
6) Na[ Al(OH)4 ] = NaAlO2 + 2H2O
t
Na2[ Zn(OH)4 ] = ZnO + H2O + NaOH
7) 2Na[ Cr(OH)4 ] + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 8H2O
Na2ZnO2 + 2HCl нед.= Zn(OH)2↓ + 2NaCl
Na2ZnO2 + 4HCl изб.= ZnCl2 + 2NaCl + 2H2O
NaAlO2 + HCl нед.+ H2O = Al(OH)3↓ + NaCl
NaAlO2 + 4HCl изб.= AlCl3 + NaCl + 2H2O
Образование комплексных солей и солей анионного типа:
а) в растворах:
1) NaOH + Al(OH)3 = Na[ Al(OH)4 ] или 3NaOH + Al(OH)3 = Na3[ Al(OH)6 ]
OH- + Al(OH)3 = [ Al(OH)4 ] — 3OH- + Al(OH)3 = [ Al(OH)6 ]3-
2) 2NaOH + Al2O3 + 3H2O = 2Na[ Al(OH)4 ] — тетрагидроксоалюминат
3) 2NaOH + 2Al + 6H2O = 2Na[ Al(OH)4 ] + 3H2↑
4) 4NaOH + AlCl3 = Na[ Al(OH)4 ] + 3NaCl
Na[ Cr(OH)4 ] ; Na3[ Cr(OH)6 ] ; Na[ Fe(OH)4 ] ; Na3[ Fe(OH)6 ]
тетрагидроксохромат гексагидроксохромат тетрагидроксоферрат гексагидроксоферрат
1) 2NaOH + Zn(OH)2 = Na2[ Zn(OH)4 ] — тетрагидроксоцинкат
2OH- + Zn(OH)2 = [ Zn(OH)4 ]2-
2) 2NaOH + ZnO + H2O = Na2[ Zn(OH)4 ]
3) 2NaOH + Zn + 2H2O = Na2[ Zn(OH)4 ] + H2↑
4) 4NaOH + ZnCl2 = Na2[ Zn(OH)4 ] + 2NaCl
Na2[ Be(OH)4 ] ; Na2[ Sn(OH)4 ] ; Na2[ Pb(OH)4 ]
тетрагидроксобериллат тетрагидроксостаннит тетрагидроксоплюмбит
t t
слабоамфотерные : Fe(OH)3 + NaOHконц = Na[ Fe(OH)4 ] ; Cu(OH)2 + 2NaOHконц >40% = Na2[ Cu(OH)4 ]
б) в расплавах:
Zn(OH)2 <=> H2ZnO2 ; Al(OH)3 <=> H3AlO3 – ортоалюминиевая кислота
HAlO2 – метаалюминиевая кислота
t
2NaOH + Zn(OH)2 = Na2ZnO2 + H2O
цинкат
tt
NaOH + Al(OH)3 = NaAlO2 + 2H2O 3NaOH + Al(OH)3 = Na3AlO3 + 3H2O
метаалюминат ортоалюминат
Na2BeO2 ; Na2SnO2 ; Na2PbO2 ; Na2CuO2
бериллат станнит плюмбит купрат (II)
NaCrO2 ; NaFeO2 ; Na2FeO4
метахромат феррат (III ) феррат ( VI )
Именные реакции:
t
1) Коновалова (нитрование): CH4 + HO-NO2 разб → CH3-NO2 + H2O
t
2) Вюрца: CH3-Br + 2Na + Br-CH3 → CH3-CH3 + 2NaBr
Cl CH3
3) Вюрца—Фиттига: t
+ 2Na + Cl-CH3 + 2NaCl
эфир t
4) Гриньяра: CH3Cl + Mg → CH3-Mg-Cl ; CH3-Mg-Cl + Cl-CH2-CH3 → CH3-CH2-CH3 + MgCl2
t
5) Дюма (декарбоксилирование): CH3-COONa + NaOH → CH4 + Na2CO3
KMnO4
6) Вагнера: CH2=CH2 + [O] + H2O → CH2-CH2
| |
OH OH
3CH2=CH2 + 2KMnO4 + 4H2O → 3 CH2-CH2 + 2MnO2↓ + 2KOH
| |
OH OH
ZnO, Al2O3
7) Лебедева: 2C2H5OH t CH2=CH-CH=CH2 + 2H2O + H2↑
t, Cr2O3, Al2O3
8) Бызова: CH3-CH2-CH2-CH3 CH2=CH-CH=CH2 + 2H2
Hg2+, H+, t O
9) Кучерова (гидратация ацетилена): CH≡CH + HOH CH3-C
H
t, AlCl3CH3
10) Фриделя-Крафтса (алкилирование): + CH3-Cl → + HCl
C актив. , t
11) Зелинского-Казанского (тримеризация): 3CH≡CH
12) Зинина: NO2 + 6[H] Zn + HCl NH2 + 2H2 O
илиC6H5NO2 + 3(NH4)2S + 7HCl → [C6H5NH3]Cl + 3S + 6NH4Cl + 2H2O
H+, t
13) Кирхгофа: (C6H10O5)n + nH2O → nC6H12O6
14) Кольбе (электролиз р-ра солей карбоновых кислот):
эл. ток
2CH3COONa + 2H2O → H2↑ + 2NaOH + CH3-CH3↑ + 2CO2↑
(K) (A)
hv α
15) Львова: CH3-CH=CH2 + Cl2 → Cl-CH2-CH=CH2 + HCl
Химическая связь и типы кристаллических решёток. | |||||
Ковалентная | неполярная (одинаковые) . неМе – неМе полярная (разные) | ||||
Атомная B, C (алмаз, графит), Si, Ge, As, Se,Te (SiO2-кварц, SiC-карбид). Молекулярная N2 . P4 . O2 , S8, H2 , F2 , Cl2, Br2 , I2 , благородные газы (искл. Rn), CO2 –«сухой лёд», NH3 ,H2 O, C6 H6 и т.д. | Очень твёрдые, тугоплавкие, нераство-римые, не проводят ток и тепло (искл. Si и Ge – п/п). | ||||
Малая твёрдость, летучие, низкая Тпл. и кип., многие не растворимы и не про-водят ток. | |||||
Ионная | Ме – неМЕ | Ионная NaCl, Li2 SO4 , KOH, Na 2 O, [CH3 –NH3] Cl | Твёрдые, хрупкие, тугоплавкие, тепло-стойкие, растворы и расплавы прово-дят ток. | ||
Металлическая | Ме | Металлическая Fe, Cu и т.п. | Ковкие, пластичные, с металлическим блеском, проводят ток и тепло. | ||
Водородная (между молекулами) | H…(O,N,F) в разных молекулах | между молекулами (H2 O)n , (HF)n H – O … H – O … ; H – F … H – F … H H | ДНК внутримолекулярная | ||
Донорно- акцепторная (ковалентная связь) | + + _ NH4 , H3O , BF4 и комплексные соединения O3, CO | H H H:N: + __ H+ → [ H-N-H ]+ ; H:O: + __ H → [ H:O:H ]+ H H H H B= IV B= III Na2 [ Zn(OH)4 ] | F F F:B: __ + :F: → [F:B:F ]- F F | ||
Источник
Скоро все будет в одном месте)
Лови чек-лист продуктивности 
Как им пользоваться: Распечатай чек-лист и повесь его над своим столом/вклей в тетрадь для подготовки к химии
Распечатай чек-лист и повесь его над своим столом/вклей в тетрадь для подготовки к химии Уверенно закрашивай те дни, и те недели, в которые ты учил(а) химию
Уверенно закрашивай те дни, и те недели, в которые ты учил(а) химию Визуально наблюдай за своим прогрессом и хвали себя
Визуально наблюдай за своим прогрессом и хвали себя И обязательно придумай себе доп-мотивации!
И обязательно придумай себе доп-мотивации!
ПРИМЕР ИСПОЛЬЗОВАНИЯ ЧЕК-ЛИСТА: ШАГ 1: поставь себе цели. Цель может быть и в одну строчку: «Буду заниматься химией 3 раза в неделю», а может быть и длиннее (по хештегу #мастер_менделеевой можешь почитать какую декларацию заполняют наши ученики)
ШАГ 1: поставь себе цели. Цель может быть и в одну строчку: «Буду заниматься химией 3 раза в неделю», а может быть и длиннее (по хештегу #мастер_менделеевой можешь почитать какую декларацию заполняют наши ученики) ШАГ 2: обязательно придумай себе вознаграждение! Пообещал(а) заниматься химией 3 раза в неделю? Обещание выполнено? Тогда смело закрась зеленым цветом неделю в чек-листе (2ая страница) и порадуй себя шоколадкой/часом игры на компьютере/прогулкой с друзьями/походом в кино. Бонус ты выбираешь сам(а) для себя!
ШАГ 2: обязательно придумай себе вознаграждение! Пообещал(а) заниматься химией 3 раза в неделю? Обещание выполнено? Тогда смело закрась зеленым цветом неделю в чек-листе (2ая страница) и порадуй себя шоколадкой/часом игры на компьютере/прогулкой с друзьями/походом в кино. Бонус ты выбираешь сам(а) для себя!
НАБЛЮДАЙ ВИЗУАЛЬНО ЗА СВОИМ ПРОГРЕССОМ И НЕ УПУСКАЙ ВРЕМЯ ВПУСТУЮ
МЕТОДИЧКА ПО РЕШЕНИЮ 27-28-29 ЗАДАНИЙ ЕГЭ
 Эта методичка объяснит тебе простым языком как решать 27-29 задачи
Эта методичка объяснит тебе простым языком как решать 27-29 задачи
В нашем проекте их справедливо называют кладбищем баллов, потому что множество ребят на экзамене допускают там ошибки 
Самое крутое, что химии в этих задачах на самом деле меньше чем математики!
Покажем тебе как использовать в основном математику и базовое понимание химических величин
В этом документе мы постарались весело и понятно объяснить самые простые способы решения таких задачек 
+ чек-лист для подготовки к ЕГЭ на год вперед СОХРАНЯЕШЬ — РАСПЕЧАТЫВАЕШЬ — УЧИШЬ МАТЕРИАЛ В ПРАВИЛЬНОМ ПОРЯДКЕ — СДАЕШЬ НА 90+
СОХРАНЯЕШЬ — РАСПЕЧАТЫВАЕШЬ — УЧИШЬ МАТЕРИАЛ В ПРАВИЛЬНОМ ПОРЯДКЕ — СДАЕШЬ НА 90+
Разобрали задания первой части ЕГЭ по химии.
__________________________________  Преподаватель-супергерой: Елена Капитан
Преподаватель-супергерой: Елена Капитан
— окончила киевский национальный университет
— педагогический стаж с 2003
— репетиторская деятельность с 2008
+ любима всеми нашими мастерами — вам она тоже понравится!
Разобрали типы связей и кристаллические решетки 
ВЫХОД РЕАКЦИИ: решение задач 
Тема: ВСЕ О МЕТАЛЛУРГИИ
Что разобрали:  Понятие металлургии
Понятие металлургии  Общие способы получения металлов
Общие способы получения металлов  Практика по 26 заданию ЕГЭ
Практика по 26 заданию ЕГЭ
Тема: Классификация органических веществ
 На этом вебинаре тебя ждет:
На этом вебинаре тебя ждет:
— Общие формулы каждого класса органических веществ (понадобится при решении 35 задачи)
— Практика по 11 заданию ЕГЭ
КАЧЕСТВЕННЫЕ РЕАКЦИИ В НЕОРГАНИЧЕСКОЙ ХИМИИ Что тебя ждет?
Что тебя ждет?
— качественный анализ на экзамене
— таблица растворимости — твоя шпаргалка?
— практика по 25 заданию
8 И 9 ЗАДАНИЕ: сложности и лайфхаки
Что тебя ждет на вебе: Лайфхаки, которые помогут упростить решения этих заданий
Лайфхаки, которые помогут упростить решения этих заданий  + будет много практики! Да да, будем повторять неорганику
+ будет много практики! Да да, будем повторять неорганику
Краткий обзор хим. свойств простых веществ
На этом вебинаре ты узнаешь:
— химические свойства всех простых веществ
— все исключения и особенности
— практику по неорганичсекой химии
Тема: ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Что разбираем: Химическое равновесие, факторы и примеры решения заданий ЕГЭ
Химическое равновесие, факторы и примеры решения заданий ЕГЭ
Тема: 34 ЗАДАЧА: основные типы
 Что разберем:
Что разберем:
Каждое действие и принцип решения
Практика по заданиям из прошлых лет
Тема: КАК ПОДГОТОВИТЬСЯ К ЕГЭ ЗА 4 МЕСЯЦА?
Тема: 10 лайфхаков для подготовки к ЕГЭ по химии на 80+ баллов
Источник
До ЕГЭ по химии осталось совсем немного — меньше полугода (вот тут календарь ЕГЭ-2018). Но наверстать упущенное и разобраться наконец в таблице растворимости и формулах — не поздно. И не только в них, если составить чёткий план и выбрать правильные материалы. О подготовке к ЕГЭ по химии — преподаватель химии и автор телеграм-канала «ФарСмацевтика» Анна Тихонова.
Рассылка «Мела»
Мы отправляем нашу интересную и очень полезную рассылку два раза в неделю: во вторник и пятницу
В этом году форма экзамена почти не изменилась: вместо 34 заданий их будет 35. Но из-за этого немного изменится система пересчёта первичных баллов в тестовые. Экзамен состоит из двух частей: первая предполагает выбор цифр или последовательности цифр (29 заданий), вторая — ответы с развёрнутым ответом (6 заданий). Максимальное количество первичных баллов, которое можно набрать за первую часть, — 40, за вторую — 20. Обычно мои ученики начинают паниковать уже на этой стадии — когда узнают о заданиях. Но на самом деле всё не так страшно, как кажется.
1. Найдите человека, которому вы сможете задавать вопросы
Необязательно нанимать репетитора. Этим человеком может быть учитель в школе или знакомый студент, который учится на химфаке. Главное — не стесняться задавать даже самые глупые, на ваш взгляд, вопросы и стараться закрывать пробелы, которые возникают во время подготовки. Поверьте, то, что у вас появляются хоть какие-то мысли насчёт химии, уже говорит о том, что процесс запущен. Смело поднимайте руку прямо во время урока, расспрашивайте репетитора, участвуйте в обсуждениях в тематических сообществах и не бойтесь выглядеть глупо в глазах других.
2. На экзамене у вас будет три официальные шпаргалки. И в них нужно разбираться
Это таблица Менделеева, таблица растворимости и ряд напряжения металлов. В них содержится около 70% информации, которая поможет вам успешно сдать экзамен. На остальные 30% от вашего успеха приходится ваше умение пользоваться ими.
Чтобы разобраться с таблицей Менделеева, нужно сначала изучить периодические свойства элементов: строение атомов элементов, электроотрицательность, металлические, неметаллические, окислительные и восстановительные свойства, валентности, степени окисления. Если запомните их — не придётся запоминать свойства каждого отдельного элемента или каждого отдельного вещества в природе. Достаточно взглянуть в таблицу и вспомнить о периодическом законе.
Подсказка для тех, кто вечно всё забывает: F (Фтор) самый сильный неметалл и самый электроотрицательный элемент, а Fr (Франций) — наоборот (самый сильный металл и наименее электроотрицательный элемент). Это поможет с чего-то начать.
3. Повторяйте математику. Химию без неё не сдать
Конечно, никто не просит вас интегрировать или дифференцировать и вообще на экзамене можно пользоваться непрограммируемым калькулятором. Но повторить темы процентов и пропорций — обязательно. Формул, которые необходимы для решения задач, не так уж и много. Запомнить нужно только основные: формула для расчёта массовой доли, массы вещества, объёма, количества вещества, плотности и выхода продукта. Зная их, вы сможете без проблем выводить другие.
Попробуйте вывести из формулы массовой доли массу раствора или, зная массу и молярную массу вещества, определить его количество. Через несколько недель тренировок вы заметите, что все эти формулы связаны между собой и, если вы что-то забыли, всегда можно вывести нужную вам формулу из другой.
4. Таблица химических реакций — ваш помощник
Веществ в химии действительно очень много, их можно систематизировать и выявить закономерности. Вам поможет таблица взаимодействия веществ между собой. Распечатайте её и держите перед глазами, когда только начнёте решать цепочки или реакции.
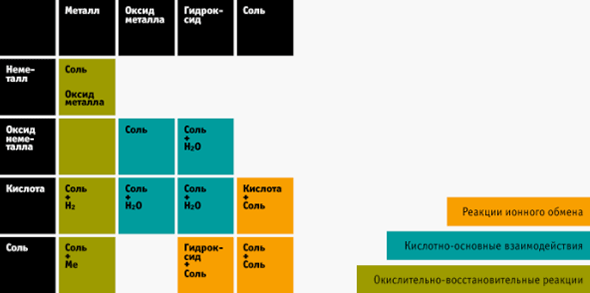
Фото: chemistrytutor.wordpress.com/15.05.2008/inorg
Как ей пользоваться?
- Научитесь определять класс веществ (оксиды, кислоты, соли, основания, металлы и неметаллы) и разберитесь в типах реакций, чем они друг от друга отличаются.
- В реакцию вступает минимум два вещества. Определяете, к какому классу относится первое вещество. Находите соответствующий пункт в таблице справа (или вверху).
- Проделайте то же самое со вторым веществом, ищите пункт сверху таблицы (или справа).
- Смотрите на пересечение этих двух пунктов в таблице — это ответ, который получается в реакции.
На экзамене такой шпаргалкой пользоваться нельзя. Но во время подготовки вы легко запомните, что получается, если, например, реагируют кислота и щелочь, и другие вещества. А это около 80% заданий на ЕГЭ.
5. Берите книжки ФИПИ и идите от простого к сложному
На самом деле не важно, какой учебник вы выберете для подготовки к ЕГЭ. Берите тот, где вам будет понятен материал и в котором есть все темы, которые встретятся на экзамене. Что касается тестов, здесь тоже не нужно изобретать велосипед: я рекомендую пользоваться книжками ФИПИ. Тот материал, который они дают, максимально приближен к тому, что будет на экзамене. И можно решать тексты по изученным темам прямо на их сайте.
Начать стоит с блоков, которые встречаются чаще всего:
- строение атома, периодические свойства элементов
- типы химической связи
- классы неорганических веществ
- гидролиз
- электролиз
- взаимодействие веществ между собой и классификация химических реакций
- задачи на тему «растворы»
- химическое равновесие
- органическая химия (классы соединений, их способы получения и химические свойства)
Остальные блоки сложнее. После того, как прорешаете задания по основным блокам, вы поймёте, в каких темах у вас пробелы, а какие вы знаете хорошо. Закрепите темы, которые вы знаете лучше остальных, и вернитесь к изучению теоретической базы тех тем, которые даются хуже. Учите тему и выполняйте по 20 упражнений в день. Если времени для подготовки мало, сосредоточьтесь на заданиях, темы которых вам ясны. Лучше целиком решить задание с ОВР (окислительно-восстановительными реакциями), чем не сделать ничего.

6. Теория хорошо, но без тестов всё равно никуда
Если кажется, что вы всё знаете из теории и вам не нужно тратить время на решение тестов — это не так. Большинство ошибок на экзамене случается из-за того, что ученик неправильно прочитал задание или не понял, что от него хотят. Чем чаще вы будете решать тесты, тем быстрее поймёте структуру экзамена и сложные и загадочные формулировки задания.
Например, в задании № 30 сказано: «Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. В ответе запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций». Очень часто ученики пропускают стадию написания полного ионного уравнения и пишут сразу сокращённое, потому что так быстрее. Это не ошибка, но за это могу снять один первичный балл.
7. А вот читать лишние статьи и литературу точно не нужно
Иногда во время подготовки к экзамену ученик настолько увлекается, что начинает читать узкоспециализированную литературу. И при ответе на простой вопрос путает самого себя: вроде бы гидроксид цинка проявляет амфотерные свойства и реагирует и с кислотами, и с основаниями, а вот в такой-то статье говорилось, что новые исследования говорят абсолютно о другом. И это ставит под сомнения все фундаментальные знания о химии! Я, конечно, утрирую, но смысл в том, что цель экзамена — проверить ваши знания школьной программы. И стратегия «чем проще, тем вернее» работает в тестах как нельзя лучше.
Источник


