Вся полезная информация по химии для егэ

| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ |
| 1.1 | Современные представления о строении атома |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. |
| 1.3 | Химическая связь и строение вещества |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. |
| 1.4 | Химическая реакция |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. |
| 1.4.6 | Реакции ионного обмена. |
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. |
| Необратимый гидролиз бинарных соединений. | |
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). |
| 2.2 | Химические свойства простых веществ — металлов |
| 2.2.1 | Характерные химические свойства щелочных металлов. |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. |
| 2.2.3 | Характерные химические свойства алюминия. |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). |
| 2.3 | Химические свойства простых веществ — неметаллов |
| 2.3.1 | Химические свойства водорода и галогенов. |
| 2.3.2 | Химические свойства кислорода и серы. |
| 2.3.3 | Химические свойства азота и фосфора. |
| 2.3.4 | Химические свойства углерода и кремния. |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. |
| 2.6 | Характерные химические свойства кислот. |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) |
| 3.8.1 | Жиры. |
| 3.8.2 | Белки. |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). |
| 3.9 | Взаимосвязь органических соединений. |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ |
| 4.1 | Экспериментальные основы химии |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. |
| 4.1.2 | Методы разделения смесей и очистки веществ. |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. |
| 4.1.5 | Качественные реакции органических соединений. |
| 4.1.7 | Основные способы получения углеводородов. |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). |
| 4.2.3 | Природные источники углеводородов, их переработка. |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. |
| 4.3.4 | Расчеты теплового эффекта реакции. |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |
Источник
Теория ЕГЭ по химии 2017
Задания 1. Электронная конфигурация атома
Задания 2. Закономерности изменения химических свойств элементов. Общая характеристика металлов, переходных элементов (меди, цинка, хрома, железа) и неметаллов
Задания 3. Электроотрицательность. Степень окисления и валентность химических элементов
Задания 4. Характеристики ковалентной, ионной, металлической и водородной связей. Зависимость свойств веществ от их состава и строения
Задания 5. Классификация и номенклатура органических и неорганических веществ
Задания 6. Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ — неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Задания 7. Характерные химические свойства оксидов: оснoвных, амфотерных, кислотных.
Задания 8. Характерные химические свойства оснований, амфотерных гидроксидов и кислот. Характерные химические свойства солей. Электролитическая диссоциация электролитов в водных растворах и Реакции ионного обмена
Задания 9. Взаимосвязь неорганических веществ
Задания 10. Реакции окислительно-восстановительные
Задания 11. Характерные химические свойства неорганических веществ:
– простых веществ – металлов: щелочных, щелочноземельных, алюминия, переходных металлов (меди, цинка, хрома, железа);
– простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния;
– оксидов: оснóвных, амфотерных, кислотных;
– оснований, амфотерных гидроксидов и кислот;
– солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
Задания 12. Классификация органических веществ. Номенклатура органических веществ(тривиальная и международная).
Задания 13. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Задания 14. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Основные способы получения углеводородов (в лаборатории).
Задания 15. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих соединений (в лаборатории).
Задания 16. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
Задания 17. Взаимосвязь углеводородов и кислородосодержащих органических соединений
Задания 18. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Задания 19. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров.
Задания 20. Классификация химических реакций в неорганической и органической химии
Задания 21. Скорость реакции, ее зависимость от различных факторов
Задания 22. Электролиз расплавов и растворов
Задания 23. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Задания 24. Обратимые и необратимые химические реакции. Химическое равновесие.Смещение равновесия под действием различных факторов
Задания 25. Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений
Задания 26. Правила работы в лаборатории. Методы разделения смесей и очистки веществ.
Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
Задания 27. Вычисление массы/ массовой доли вещества в растворе
Задания 28. Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции
Задания 29. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
Задания 27. Классификация органических и неорганических соединений
Задания 30. Реакции окислительно-восстановительные.
Задания 31. Взаимосвязь различных классов неорганических веществ
Задания 32. Взаимосвязь органических соединений
Задания 33. Расчетные задачи на примеси, избыток-недостаток, выход от теоретически возможного, массовую долю растворенного вещества, массовую долю химического соединения в смеси
Задания 34. Нахождение молекулярной формулы вещества
Источник
До ЕГЭ по химии осталось совсем немного — меньше полугода (вот тут календарь ЕГЭ-2018). Но наверстать упущенное и разобраться наконец в таблице растворимости и формулах — не поздно. И не только в них, если составить чёткий план и выбрать правильные материалы. О подготовке к ЕГЭ по химии — преподаватель химии и автор телеграм-канала «ФарСмацевтика» Анна Тихонова.
Рассылка «Мела»
Мы отправляем нашу интересную и очень полезную рассылку два раза в неделю: во вторник и пятницу
В этом году форма экзамена почти не изменилась: вместо 34 заданий их будет 35. Но из-за этого немного изменится система пересчёта первичных баллов в тестовые. Экзамен состоит из двух частей: первая предполагает выбор цифр или последовательности цифр (29 заданий), вторая — ответы с развёрнутым ответом (6 заданий). Максимальное количество первичных баллов, которое можно набрать за первую часть, — 40, за вторую — 20. Обычно мои ученики начинают паниковать уже на этой стадии — когда узнают о заданиях. Но на самом деле всё не так страшно, как кажется.
1. Найдите человека, которому вы сможете задавать вопросы
Необязательно нанимать репетитора. Этим человеком может быть учитель в школе или знакомый студент, который учится на химфаке. Главное — не стесняться задавать даже самые глупые, на ваш взгляд, вопросы и стараться закрывать пробелы, которые возникают во время подготовки. Поверьте, то, что у вас появляются хоть какие-то мысли насчёт химии, уже говорит о том, что процесс запущен. Смело поднимайте руку прямо во время урока, расспрашивайте репетитора, участвуйте в обсуждениях в тематических сообществах и не бойтесь выглядеть глупо в глазах других.

2. На экзамене у вас будет три официальные шпаргалки. И в них нужно разбираться
Это таблица Менделеева, таблица растворимости и ряд напряжения металлов. В них содержится около 70% информации, которая поможет вам успешно сдать экзамен. На остальные 30% от вашего успеха приходится ваше умение пользоваться ими.
Чтобы разобраться с таблицей Менделеева, нужно сначала изучить периодические свойства элементов: строение атомов элементов, электроотрицательность, металлические, неметаллические, окислительные и восстановительные свойства, валентности, степени окисления. Если запомните их — не придётся запоминать свойства каждого отдельного элемента или каждого отдельного вещества в природе. Достаточно взглянуть в таблицу и вспомнить о периодическом законе.
Подсказка для тех, кто вечно всё забывает: F (Фтор) самый сильный неметалл и самый электроотрицательный элемент, а Fr (Франций) — наоборот (самый сильный металл и наименее электроотрицательный элемент). Это поможет с чего-то начать.
3. Повторяйте математику. Химию без неё не сдать
Конечно, никто не просит вас интегрировать или дифференцировать и вообще на экзамене можно пользоваться непрограммируемым калькулятором. Но повторить темы процентов и пропорций — обязательно. Формул, которые необходимы для решения задач, не так уж и много. Запомнить нужно только основные: формула для расчёта массовой доли, массы вещества, объёма, количества вещества, плотности и выхода продукта. Зная их, вы сможете без проблем выводить другие.
Попробуйте вывести из формулы массовой доли массу раствора или, зная массу и молярную массу вещества, определить его количество. Через несколько недель тренировок вы заметите, что все эти формулы связаны между собой и, если вы что-то забыли, всегда можно вывести нужную вам формулу из другой.
4. Таблица химических реакций — ваш помощник
Веществ в химии действительно очень много, их можно систематизировать и выявить закономерности. Вам поможет таблица взаимодействия веществ между собой. Распечатайте её и держите перед глазами, когда только начнёте решать цепочки или реакции.
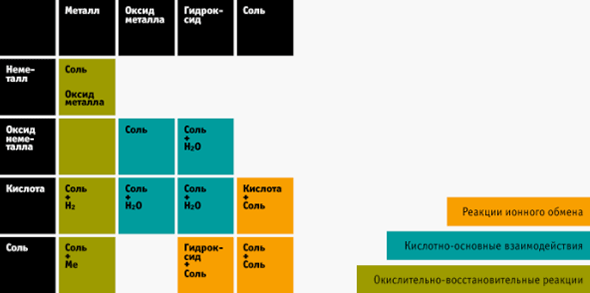
Фото: chemistrytutor.wordpress.com/15.05.2008/inorg
Как ей пользоваться?
- Научитесь определять класс веществ (оксиды, кислоты, соли, основания, металлы и неметаллы) и разберитесь в типах реакций, чем они друг от друга отличаются.
- В реакцию вступает минимум два вещества. Определяете, к какому классу относится первое вещество. Находите соответствующий пункт в таблице справа (или вверху).
- Проделайте то же самое со вторым веществом, ищите пункт сверху таблицы (или справа).
- Смотрите на пересечение этих двух пунктов в таблице — это ответ, который получается в реакции.
На экзамене такой шпаргалкой пользоваться нельзя. Но во время подготовки вы легко запомните, что получается, если, например, реагируют кислота и щелочь, и другие вещества. А это около 80% заданий на ЕГЭ.
5. Берите книжки ФИПИ и идите от простого к сложному
На самом деле не важно, какой учебник вы выберете для подготовки к ЕГЭ. Берите тот, где вам будет понятен материал и в котором есть все темы, которые встретятся на экзамене. Что касается тестов, здесь тоже не нужно изобретать велосипед: я рекомендую пользоваться книжками ФИПИ. Тот материал, который они дают, максимально приближен к тому, что будет на экзамене. И можно решать тексты по изученным темам прямо на их сайте.
Начать стоит с блоков, которые встречаются чаще всего:
- строение атома, периодические свойства элементов
- типы химической связи
- классы неорганических веществ
- гидролиз
- электролиз
- взаимодействие веществ между собой и классификация химических реакций
- задачи на тему «растворы»
- химическое равновесие
- органическая химия (классы соединений, их способы получения и химические свойства)
Остальные блоки сложнее. После того, как прорешаете задания по основным блокам, вы поймёте, в каких темах у вас пробелы, а какие вы знаете хорошо. Закрепите темы, которые вы знаете лучше остальных, и вернитесь к изучению теоретической базы тех тем, которые даются хуже. Учите тему и выполняйте по 20 упражнений в день. Если времени для подготовки мало, сосредоточьтесь на заданиях, темы которых вам ясны. Лучше целиком решить задание с ОВР (окислительно-восстановительными реакциями), чем не сделать ничего.

6. Теория хорошо, но без тестов всё равно никуда
Если кажется, что вы всё знаете из теории и вам не нужно тратить время на решение тестов — это не так. Большинство ошибок на экзамене случается из-за того, что ученик неправильно прочитал задание или не понял, что от него хотят. Чем чаще вы будете решать тесты, тем быстрее поймёте структуру экзамена и сложные и загадочные формулировки задания.
Например, в задании № 30 сказано: «Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. В ответе запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций». Очень часто ученики пропускают стадию написания полного ионного уравнения и пишут сразу сокращённое, потому что так быстрее. Это не ошибка, но за это могу снять один первичный балл.
7. А вот читать лишние статьи и литературу точно не нужно
Иногда во время подготовки к экзамену ученик настолько увлекается, что начинает читать узкоспециализированную литературу. И при ответе на простой вопрос путает самого себя: вроде бы гидроксид цинка проявляет амфотерные свойства и реагирует и с кислотами, и с основаниями, а вот в такой-то статье говорилось, что новые исследования говорят абсолютно о другом. И это ставит под сомнения все фундаментальные знания о химии! Я, конечно, утрирую, но смысл в том, что цель экзамена — проверить ваши знания школьной программы. И стратегия «чем проще, тем вернее» работает в тестах как нельзя лучше.
Источник
Материалы для самоподготовки к ЕГЭ по химии.Материалы для самоподготовки к ЕГЭ по химии. Представлены задания с сайта https://www.fipi.ru и собственные разработки ИСПОЛЬЗОВАНА НУМЕРАЦИЯ ЕГЭ 2016
|
Источник

